学位論文要旨
| No | 212671 | |
| 著者(漢字) | 杉田,和幸 | |
| 著者(英字) | ||
| 著者(カナ) | スギタ,カズユキ | |
| 標題(和) | ホルボール関連物質の合成と生物活性評価に関する研究 | |
| 標題(洋) | ||
| 報告番号 | 212671 | |
| 報告番号 | 乙12671 | |
| 学位授与日 | 1996.02.07 | |
| 学位種別 | 論文博士 | |
| 学位種類 | 博士(薬学) | |
| 学位記番号 | 第12671号 | |
| 研究科 | ||
| 専攻 | ||
| 論文審査委員 | ||
| 内容要旨 | 強力な発癌プロモーターとして知られるPhorbol Myristate Acetate(PMA)は、セリン/スレオニン燐酸化酵素であるプロテインキナーゼC(PKC)に結合しPKCを活性化する。このPKCは、生体の細胞内情報伝達機構において重要な役割を果たしていることが示唆されているが、メカニズムについては未だ十分に明らかにされていない。PKCには十数種のサブタイプが知られており分子種が多く、特異的活性化剤が存在しないことも、メカニズム解明の障害の一つとなっている。更に、PKC以外のレセプターの存在の可能性も報告されている。PMAのレセプターへの結合部位に関しては、数多くのグループにより、他のPMAタイプの発癌プロモーターとの比較から構造活性相関が検討されているが、レセプターの三次元構造が明らかにされていないため、その証明はなされていない。また、C環12位の疎水性基を除いてPMAと同じ構造を有するプロストラチンは、近年、抗HIV活性を持つ一方で発癌プロモーション活性は持たないことが報告されている。 そこで私は、抗癌あるいは抗HIV薬への展開をも考慮にいれつつ、構造活性相関の解明、及びこれら細胞内情報伝達機構の解明において重要なバイオロジカルツールとなり得る化合物の獲得を目指して、標的化合物を設定し合成を行い、更にそれらのPKCへの結合試験を実施した。 ホルボール誘導体の発癌プロモーション活性に関する構造活性相関については、首藤-板井、岸、Wender等により報告されているが、そこでは主に、12位の疎水性基、及び3、4、6、9位に有する酸素官能基群が活性発現に必要であるとされている。12位については、疎水性基を持たないプロストラチンが発癌プロモーション活性を持たないことから、その必要性は明らかである。6位ヒドロキシメチル基については活性発現に必要とされ、化合物1、2の活性の比較によりその確認ができると考えられる。また、11位メチル基、及び13位アセトキシ基に関しては、レセプターへの結合には関与をしないとされているが、その証明は成されておらず、化合物1とPMAとの比較により情報を得られると考えられる。既に、柴崎らは化合物5の立体選択的合成に成功している。 本研究では、化合物3、4を合成し更に、構造活性相関の研究上重要と考えらる1、2の合成に成功し、PKCとのbinding assayを行った。なお、ホルボールは高度に官能基化されたジテルペノイドでありWenderらのラセミ体での全合成を含めて、基本骨格の合成は四例のみである。本研究は光学活性体での合成であり、これも本研究の大きな特長の一つである。  標的化合物1、2の合成は、Scheme1.に示す逆合成解析により計画した。A環は分子内アルドール反応により、またB、C環は、それぞれ分子内二トリルオキシド環化付加反応を利用して、立体特異的に構築することとした。原料は、光学的に純粋で、安価に入手容易な化合物(+)-3-careneを用いた。  柴崎らの報告している方法に従い12工程で得られる10を大量に合成し、検討を開始した。  10を速度論的に脱プロトン化後、ジルコニウムエノラートへと導き、次いでフェニルセレネニル化しmCPBAを用いて酸化して、  9の三級水酸基をSEMエーテルとして保護し、LAHを用いて脱ピバロイル化を行い、DMSO中SO3・pyridine錯体による酸化を経て13とした。この13と14との縮合反応を、トルエン中LiBr存在下LHMDSを用いて行うことにより、15を単一成績体として95%の収率で得ることに成功した。なお本反応において塩基としてKHMDSを使うとSEMO基の ここに、12位に疎水性基を有し、活性発現に必要とされる官能基を全て備え、天然のホルボールと同じ骨格を持った化合物の光学活性体での合成に成功した。 化合物1の立体化学については、化合物23のNOEを測定することにより決定した。  6位にヒドロキシメチル基を持たない化合物2も、化合物1と同様の方法で合成した。すなわち、13よりアルデヒド34へ導き、Wittig反応を経由し35とした。なお、このWittig反応では、目的のシス体のみが得られている。次に、ニトロ体36へと導き、分子内二トリルオキシド環化付加反応を行い38を得た。イソキサゾリン環を開環し39とした後、アシルアニオン等価体の導入を行い41へと変換し、更に42へと導いた後、分子内アルドール反応を行い、疎水性基の導入を行い化合物2の合成に成功した。   12位に酸素官能基を持たない化合物3、4は化合物10より1、2と同様の方法で合成を行った。 合成した化合物1、2についてPKCとのbinding assayを行った。すなわち、ラット脳より得られたPKC(サブタイブ blumbergらのPKC  本研究では、光学活性化合物(+)-3-careneより出発し、二度の分子内ニトリルオキシド環化付加反応を経由し、PMAについて活性発現に必要とされる全ての官能基が立体選択的に導入された1、及び2、3、4の光学活性体での合成に成功し、更に1、2、及び32、33、34、35についてPKCとのbinding assayを行った。 その結果まず第一に、PKCとの結合において6位ヒドロキシメチル基が重要であること、第二に、結合に必要とされる官能基を備えた1が、PMAの約百分の一のbinding affinityを示す一方で、より脂肪鎖の短いC-10の側鎖を持つ33においてほぼPMAと同等のPKCへのaffinityを持つことが明らかとなった。 | |
| 審査要旨 | 強力な発癌プロモーターとして知られるPhorbol Myristate Acetate(PMA)は、蛋白質リン酸化酵素であるプロテインキナーゼC(PKC)に結合しPKCを活性化する。このPKCは、生体の細胞内情報伝達機構において重要な役割を果たしていることが示唆されているが、その機構については未だ十分には明らかにされていない。PKCには十数種のサブタイプが存在するため、PKCの研究を高精度で行うためには、個々のサブタイプに特異的なPKCの活性化剤あるいは阻害剤の開発が必要とされている。一方、PMAのPKCに対する結合部位に関しても、多くのグループにより検討されているにもかかわらず、明らかとなっていない。また、PMAに類似の構造を有するプロストラチンは、近年、抗HIV活性を持つ一方で発癌プロモーション活性は持たないことが報告され、注目を集めている。 杉田和幸は、上記の点に鑑みPMAの構造活性相関と、細胞内情報伝達機構の解明において重要なバイオロジカルツールとなり得る化合物の獲得を目指して、標的化合物として下記の1〜5を設定し合成を行い、更にそれらのPKCへの結合試験を実施した。  代表例として標的化合物1の合成経路をScheme1に示す。原料としては、D環部を有し、光学的に純粋で安価に入手容易な(+)-3-careneを用いている。B、C環は、それぞれ分子内ニトリルオキシド環化付加反応を利用して、また、A環は分子内アルドール反応により、立体特異的な構築に成功している。他の誘導体2〜5についても同様の経路により合成に成功している。  合成した化合物1、2についてPKCに対する結合試験を行った結果、Table1に示すように、1はPMAと比較して2オーダー程度弱いながらPKCとの結合が認められるのに対し、6位にヒドロキシメチルを持たない2は10-5MでもPKCとの結合を示さないことを見いだした。また、化合物1のC-12位の側鎖を炭素数6〜12の脂肪酸で種々変換した化合物17〜20を合成して同様の結合試験を行い、側鎖脂肪酸の炭素数10の誘導体18はPMAと比肩しうるPKC結合能を有することを見いだした(Table2)。  以上、本結果は、活性発現に必要と考えられる官能基をすべて有するホルボール誘導体を、光学活性体として合成した初めての例であり、1及び2の合成においては7カ所の不斉点の立体配置のほぼ完璧な制御に成功している。また、PKCとの結合試験においてはC-6位のヒドロキシメチル基がPKCとの結合に重要であるのに対し、C-11位のメチル基、C-13位のアセトキシル基は必須ではないことを明らかとし、さらに、C-12位側鎖疎水性基の重要性を見いだしている。有機合成化学ならびに動的天然物化学の発展に寄与するところが大であり、博士(薬学)の学位に値するものと判定した。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/53934 |
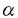 ,
, -不飽和ケトンとした。これをジメチルジオキシランを用いてエポキシ化し、
-不飽和ケトンとした。これをジメチルジオキシランを用いてエポキシ化し、 のmixture)に、tritiumラベルしたphorbol-12,13-dibutylate(PDBu)10nMに対してcoldのPMA、1、2の3薬剤をそれぞれ競合結合させた。その結果、1はPMAの約百分の一のbinding affinityを示し、6位にヒドロキシメチル基を持たない2は10-5MでもPDBuの結合阻害を起こさなかった。そこで12位疎水性基の短い化合物を合成し、binding assayを行った。その結果、C-10の脂肪酸エステルを持つ化合物33において極大のbinding affinityを示すことが明らかとなった。
のmixture)に、tritiumラベルしたphorbol-12,13-dibutylate(PDBu)10nMに対してcoldのPMA、1、2の3薬剤をそれぞれ競合結合させた。その結果、1はPMAの約百分の一のbinding affinityを示し、6位にヒドロキシメチル基を持たない2は10-5MでもPDBuの結合阻害を起こさなかった。そこで12位疎水性基の短い化合物を合成し、binding assayを行った。その結果、C-10の脂肪酸エステルを持つ化合物33において極大のbinding affinityを示すことが明らかとなった。 のPMA結合部位であるCys2とのX線結晶構造解析によるPMAとの結合様式においては、C環上部より上の部位はPKCの膜への移行に関与すると考えられている。上記のbindingassayの結果は特に13位アセトキシ基の欠如による脂溶性の増加分を、12位疎水性基の長さで埋め合わせていると考えることができる。PMAと1とでは、構造上の違いは11位及び13位の二つの置換基の有無だけである。研究開始時に行われた分子力場計算により得られた最安定コンフォメーションについては、11位あるいは13位置換基の有無による変化は見られておらず、以上の推察を支持している。今後、更に生物化学試験を実施することによって、細胞内情報伝達機構の解明に寄与できるものと考えられる。
のPMA結合部位であるCys2とのX線結晶構造解析によるPMAとの結合様式においては、C環上部より上の部位はPKCの膜への移行に関与すると考えられている。上記のbindingassayの結果は特に13位アセトキシ基の欠如による脂溶性の増加分を、12位疎水性基の長さで埋め合わせていると考えることができる。PMAと1とでは、構造上の違いは11位及び13位の二つの置換基の有無だけである。研究開始時に行われた分子力場計算により得られた最安定コンフォメーションについては、11位あるいは13位置換基の有無による変化は見られておらず、以上の推察を支持している。今後、更に生物化学試験を実施することによって、細胞内情報伝達機構の解明に寄与できるものと考えられる。