| 緒言 それ自体酵素活性を持たない受容体からの刺激情報伝達系において、チロシンリン酸化蛋白が重要な役割を果たしている事例が近年次々と報告されている。このチロシンリン酸化を担う酵素はタンパク質チロシンキナーゼ(=protein tyrosine kinase,以下PTK)と呼ばれる。 抗原物質が体内に侵入すると、その物質に特異的なIgEが産生されるようになる。一方、好塩基球やマスト細胞の細胞膜表面上には高親和性IgE受容体であるFc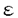 RIが発現しており、産生された抗原特異的IgEを結合している。アレルゲンが多価抗原物質としてこのIgEに結合することでIgEの凝集、ひいてはFc RIが発現しており、産生された抗原特異的IgEを結合している。アレルゲンが多価抗原物質としてこのIgEに結合することでIgEの凝集、ひいてはFc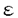 RIの凝集が誘起される。これが引き金となって、ヒスタミシ等の脱顆粒にいたるシグナル・カスケードが活性化される。Fc RIの凝集が誘起される。これが引き金となって、ヒスタミシ等の脱顆粒にいたるシグナル・カスケードが活性化される。Fc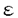 RI凝集はいくつかの細胞内タンパク質のチロシンリン酸化を引き起こすことが報告されている。これらのチロシンリシ酸化蛋白にはFc RI凝集はいくつかの細胞内タンパク質のチロシンリン酸化を引き起こすことが報告されている。これらのチロシンリシ酸化蛋白にはFc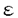 RI RI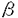 鎖、 鎖、 鎖、そしてPTKであるLyn、Sykなどが含まれている。 鎖、そしてPTKであるLyn、Sykなどが含まれている。 Fc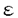 RIは4つの膜貫通性コンパートメシトから構成されている。 RIは4つの膜貫通性コンパートメシトから構成されている。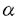 鎖は細胞外に2つの免疫グロプリン相同ドメインを持ち、IgEと直接結合する。 鎖は細胞外に2つの免疫グロプリン相同ドメインを持ち、IgEと直接結合する。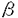 鎖はそのN末端およびC末端ともに細胞内に存在し、膜を4回貫通している。 鎖はそのN末端およびC末端ともに細胞内に存在し、膜を4回貫通している。 鎖は膜貫通部位で2分子がS-S結合によるホモダイマーを形成しており、そのほとんどの部位は細胞内ドメインである。これら4鎖は膜貫通部位で会合している。 鎖は膜貫通部位で2分子がS-S結合によるホモダイマーを形成しており、そのほとんどの部位は細胞内ドメインである。これら4鎖は膜貫通部位で会合している。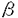 鎖、 鎖、 鎖にはTAM(=tyrosine-based activation motif)と呼ばれる情報伝達に必須のモチーフが存在している。 鎖にはTAM(=tyrosine-based activation motif)と呼ばれる情報伝達に必須のモチーフが存在している。 本論文ではFc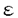 RI凝集が誘起する情報伝達系に2つのPTK LynとSykが受容体とTAMを介して関与している様式の検討について報告する。 RI凝集が誘起する情報伝達系に2つのPTK LynとSykが受容体とTAMを介して関与している様式の検討について報告する。 方法 Fc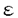 RI RI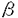 、 、 鎖の細胞内ドメインをE.Coliにより発現、精製した。リコンビナント 鎖の細胞内ドメインをE.Coliにより発現、精製した。リコンビナント 鎖はウサギの免疫に使用し、ポリクローナル抗Fc 鎖はウサギの免疫に使用し、ポリクローナル抗Fc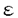 RI RI 鎮抗体を作成した。 鎮抗体を作成した。 抗Syk抗体にてラットのマスト細胞細胞株であるRBL-2H3細胞の細胞融解物を免疫沈降し、沈降物をSDS-PAGE法およびウエスタン・プロット法で解析した。 ラットsykの5’末端cDNA配列は未知であったため、5’RACE(=rapid amplification of the cDNA ends)法を施行、全配列を決定した。 ラットのLyn、SykのSH2ドメインとGSTとの融合蛋白をE.Coliにより発現、精製した。これらのSH2融合タンパクが会合しうるRBL-2H3細胞の細胞融解物をSDS-PAGE法およびウエスタン・プロット法にて検討した。 同様の実験をリン酸化チロシン、リン酸化セリン、リン酸化スレオニンの存在下において施行し融合タンパクとその会合タンパクとの結合様式を調べた。 免疫沈降したFc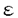 RI RI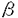 、 、 鎖をPVDF膜上に固定し、SH2融合タンパクとの直接結合性を解析した。 鎖をPVDF膜上に固定し、SH2融合タンパクとの直接結合性を解析した。 SykのSH2ドメインSH2融合タンパクについてはリン酸化ペプチド・ライブラリーを用いて結合するTAMの配列を決定した。 リコンビナシト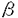 、 、 鎖を基質としたLyn、Sykの活性を調べるためにin vitroキナーゼ・アッセイを行った。 鎖を基質としたLyn、Sykの活性を調べるためにin vitroキナーゼ・アッセイを行った。 結論 ゆるやかに可溶化したRBL-2H3細胞をSH2融合タンパクで沈降し、会合するチロシンリン酸化タンパクを解析すると、LynのSH2は刺激前細胞からいくつかの、そして刺激後細胞からは非常に多くのチロシンリン酸化タンパクを沈降する性格を持っていることがわかった。他方Sykの直列2分子SH2の融合タンパクを用いた場合、刺激前細胞からは全くチロシンリン酸化タンパクは沈降せず、刺激後細胞からのみ極く限られた3種の分子量を持つチロシンリン酸化タンパクのみを沈降した。これらの分子量はそれぞれ180kDa、28kDa、7kDaで、後2者はそれぞれFc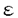 RI RI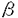 鎖、 鎖、 鎖であることが特異的抗体を用いたウエスタン・プロッティングにより判明した。SykのN、C末端SH2を単独で発現させた融合タンパクを用いた場合、これらのタンパクとの会合は弱く、特にN末端SH2ではほとんど沈降がみられなかった。なお、LynのSH2が沈降した多数のチロシンリン酸化タンパクには 鎖であることが特異的抗体を用いたウエスタン・プロッティングにより判明した。SykのN、C末端SH2を単独で発現させた融合タンパクを用いた場合、これらのタンパクとの会合は弱く、特にN末端SH2ではほとんど沈降がみられなかった。なお、LynのSH2が沈降した多数のチロシンリン酸化タンパクには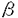 鎖、 鎖、 鎖、Sykが含まれていた。同様の実験をリン酸化チロシン、リン酸化セリン、リン酸化スレオニンの存在下で行なったところリン酸化チロシンのみが上述の会合を阻害し、これらの会合がリン酸化チロシンに依存していることが確認できた。すなわち、SykのSH2ドメインは2つがそろっているときのみチロシンリン酸化した 鎖、Sykが含まれていた。同様の実験をリン酸化チロシン、リン酸化セリン、リン酸化スレオニンの存在下で行なったところリン酸化チロシンのみが上述の会合を阻害し、これらの会合がリン酸化チロシンに依存していることが確認できた。すなわち、SykのSH2ドメインは2つがそろっているときのみチロシンリン酸化した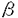 鎖、 鎖、 鎖,および未知の180kDaチロシンリン酸化タンパクと効率よく会合し、LynのSH2と比較して非常に選択性が高いという性格を持つことがわかった。 鎖,および未知の180kDaチロシンリン酸化タンパクと効率よく会合し、LynのSH2と比較して非常に選択性が高いという性格を持つことがわかった。 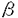 鎖と 鎖と 鎖は膜貫通部位で会合していることが知られており、沈降の実験のみからではそれぞれのSH2融合タンパクがどちらのコシポーネントと直接の会合をしているか知ることはできない。そこで次に抗 鎖は膜貫通部位で会合していることが知られており、沈降の実験のみからではそれぞれのSH2融合タンパクがどちらのコシポーネントと直接の会合をしているか知ることはできない。そこで次に抗 鎖抗体によってFc 鎖抗体によってFc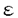 RIを免疫沈降しSDS-PAGEに展開、PVDF上に RIを免疫沈降しSDS-PAGEに展開、PVDF上に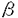 鎖と 鎖と 鎮をトランスファーして固定し、これを使用してSH2との直接の結合を調べた。この結果非常に興味深いことに、SykのSH2はもっぱら 鎮をトランスファーして固定し、これを使用してSH2との直接の結合を調べた。この結果非常に興味深いことに、SykのSH2はもっぱら 鎖と結合し、 鎖と結合し、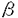 鎖との結合は非常に弱く、逆にLynのSH2は 鎖との結合は非常に弱く、逆にLynのSH2は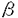 鎖のみと結合し、 鎖のみと結合し、 鎖との結合は全く見られないことが判明した。 鎖との結合は全く見られないことが判明した。 In vitroキナーゼ・アッセイの結果からは、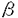 鎖、 鎖、 鎖ともがLynの基質となりうることがわかった。 鎖ともがLynの基質となりうることがわかった。 考案 これらの実験結果から、Sykについては2つのSH2が協調して主にチロシンリン酸化した 鎖に会合する一方でLynは単独SH2ドメインを介してチロシンリン酸化した 鎖に会合する一方でLynは単独SH2ドメインを介してチロシンリン酸化した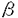 鎖に会合することがわかる。この相違はひとつにSH2とその結合しやすいTAMとの間に特異性があるためと考えられる。実際、 鎖に会合することがわかる。この相違はひとつにSH2とその結合しやすいTAMとの間に特異性があるためと考えられる。実際、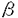 鎖に存在するTAMはYEELという配列を含んでいるが、これは合成ペプチドを用いた研究によりSrcファミリーPTKのSH2ドメインが結合しやすい配列であることが報告されている。もうひとつのYSALという配列が 鎖に存在するTAMはYEELという配列を含んでいるが、これは合成ペプチドを用いた研究によりSrcファミリーPTKのSH2ドメインが結合しやすい配列であることが報告されている。もうひとつのYSALという配列が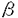 鎖TAMに存在するが、これと会合しうるSH2ドメインを持つ物質は不明である。Sykの2つのSH2ドメインは 鎖TAMに存在するが、これと会合しうるSH2ドメインを持つ物質は不明である。Sykの2つのSH2ドメインは 鎖TAM上のYTGL、YETLと結合するものと推定されるがN、C末端どちらのSH2ドメインがどちらのモチーフと結合するのかは今回ペプチドライブラリーを用いた解析からも明確にし得なかった。T細胞においてSykファミリーに属するPTKであるZAP-70のSH2も直列に2つ並んだ状態でT細胞受容体 鎖TAM上のYTGL、YETLと結合するものと推定されるがN、C末端どちらのSH2ドメインがどちらのモチーフと結合するのかは今回ペプチドライブラリーを用いた解析からも明確にし得なかった。T細胞においてSykファミリーに属するPTKであるZAP-70のSH2も直列に2つ並んだ状態でT細胞受容体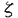 鎖とCD3 鎖とCD3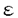 鎖に特異的に会合するといった、Sykと同様の性格を持つことがわかっており、直列にならんだ2つのSH2ドメインの協調、そしてSrcファミリーPTKのSH2ドメインに比べて高い選択性をもつことがSykファミリーPTKのSH2ドメインが持つ特徴であると考えられる。 鎖に特異的に会合するといった、Sykと同様の性格を持つことがわかっており、直列にならんだ2つのSH2ドメインの協調、そしてSrcファミリーPTKのSH2ドメインに比べて高い選択性をもつことがSykファミリーPTKのSH2ドメインが持つ特徴であると考えられる。 以上の事項から、Fc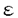 RIを介するシグナル伝達について次のようなモデルが想定できる。Fc RIを介するシグナル伝達について次のようなモデルが想定できる。Fc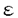 RIの凝集はすでにその近辺にGD1bガングリオシドを介して存在しているLynの活性化を引き起こす。この段階においてLynの活性化に必要と考えられるホスファターゼについては未だ同定されていない。活性化したLynは RIの凝集はすでにその近辺にGD1bガングリオシドを介して存在しているLynの活性化を引き起こす。この段階においてLynの活性化に必要と考えられるホスファターゼについては未だ同定されていない。活性化したLynは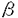 鎖と 鎖と 鎖をチロシンリン酸化し、LynSH2ドメインを介してリン酸化した 鎖をチロシンリン酸化し、LynSH2ドメインを介してリン酸化した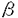 鎖と堅固に結合し、より安定にFc 鎖と堅固に結合し、より安定にFc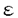 RI近傍に存在することで未知のホスファターゼによる RI近傍に存在することで未知のホスファターゼによる 鎖の脱リン酸化に競合する。チロシンリン酸化した 鎖の脱リン酸化に競合する。チロシンリン酸化した 鎖は細胞内のSykをSH2ドメインを介して細胞表面に引き寄せ、SykはTAMとSH2ドメインの結合、細胞表面での凝集によるアロステリックなコンフォメーションの変化、ないし未知の機序によって活性化し、下流へシグナルを伝えるようになる。 鎖は細胞内のSykをSH2ドメインを介して細胞表面に引き寄せ、SykはTAMとSH2ドメインの結合、細胞表面での凝集によるアロステリックなコンフォメーションの変化、ないし未知の機序によって活性化し、下流へシグナルを伝えるようになる。 本研究で明らかになったようにLynおよびSykのSH2ドメインはそれぞれユニークな性格でFc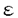 RIからのシグナル伝達に関わっている。またLynのSH2ドメインが刺激後細胞のSykと会合することを本論文にて証明したが、同様にT細胞においてSrcファミリーPTKであるLckがSH2メインを介してSykファミリーPTKであるZAP-70と直接に会合することが報告されており、これら2種のPTKの間のクロストークの意義に興味が持たれる。SH3や特異的領域による会合や活性制御、そしてこれらのPTKの下流に位置するシグナル伝達物質についても解明する必要がある。 RIからのシグナル伝達に関わっている。またLynのSH2ドメインが刺激後細胞のSykと会合することを本論文にて証明したが、同様にT細胞においてSrcファミリーPTKであるLckがSH2メインを介してSykファミリーPTKであるZAP-70と直接に会合することが報告されており、これら2種のPTKの間のクロストークの意義に興味が持たれる。SH3や特異的領域による会合や活性制御、そしてこれらのPTKの下流に位置するシグナル伝達物質についても解明する必要がある。 |