1988年、協和発酵グループにより放線菌から単離されたデュオカルマイシンA(1)は、強力な抗腫瘍活性を有する抗生物質であり、DNAの特定の塩基対を認識してアルキル化するという新しいメカニズムを有する新規抗腫瘍活性物質として大変注目されている。  著者は、1の有する強力な抗腫瘍活性とユニークな構造に着目し、天然型(+)-1およびその3種の立体異性体を全合成し、立体化学と細胞毒性との関連を解明する目的で本研究に着手した。 まず、合成工程の確立を目標としてdl-1の合成を試みた。文献に従って合成した2から誘導したdl-3をガスマン反応、続く塩化第二銅/酸化第二銅の処理によりdl-4を得た[Scheme 1]。 dl-5をdl-6へと変換し、アルキル化してdl-7を得た。dl-7をホルミル化した後,ディークマン縮合反応を行い、dl-9、dl-10を分離可能なジアステレオマーとして得た[Scheme 2]。  図表Scheme 1 / Scheme 2 図表Scheme 1 / Scheme 2 次にdl-9の3つの保護基を同時に除去してdl-11とし、リースらの報告を参考にして合成した3,4,5-トリメトキシインドール-2-カルボン酸と縮合させてdl-12を得た。dl-12をメシル化、脱保譲してdl-14とし、水素化ナトリウムで処理して、目的とするdl-1の全合成を完成した[Scheme 3]。 全く同様にして、dl-10から2-エピ体であるdl-15を合成した[Scheme 4]。  図表Scheme 3 / Scheme 4 図表Scheme 3 / Scheme 4 次に、dl-1とdl-15の光学活性体の合成を、アルコール体(dl-16、dl-19)の光学分割を経る方法で検討した[Scheme 5、6]。dl-16と(S)-O-アセチルマンデル酸のエステルを高速液体クロマトグラフィーによって分離し、得られたジアステレオマー[(+)-17、(-)-18]から(+)-、(-)-1を得た。一方のdl-10についても、dl-16と全く同様に処理して(+)-、(-)-15を得た。得られた(+)-、(-)-15は、これらが非天然化合物であり、また2個の不斉中心を有するdl-19の光学分割を経て誘導したことから、その立体化学を決定することはできなかった。  図表Scheme 5 / Scheme 6 図表Scheme 5 / Scheme 6 そこで、次に(+)-、 (-)-15の絶対配置を決定するために、1個の不斉炭素を有するdl-22の光学分割を試みた。その結果、dl-22と新規な光学分割剤(S)-N-シンナモイルプロリンのエステルがシリカゲルカラムクロマトグラフィーで容易に分離可能なジアステレオマー(23、24)を与えた[Scheme 7]。23から得られた(-)-6を(+)-9および(-)-10とし、それぞれを(+)-17、 (-)-20へ導いた[Scheme 8]。これらの比旋光度値から、(+)-17は天然型(+)-1に、(-)-20は(+)-15に導かれたものと判明し、(+)-、(-)-15の絶対配置が明確に決定された。 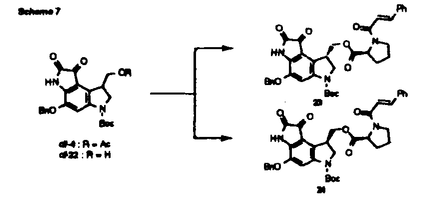 Scheme 7 Scheme 7 Scheme 8 Scheme 8 次に、得られた(+)-、(-)-1および(+)-、(-)-15をマウス白血病P388細胞を用いたin vitro細胞毒性試験に供した[Table 1]。その結果、デュオカルマイシンAにおいては、2位よりもシクロプロパン環の立体化学の方が細胞毒性に大きく影響することが明らかとなった。  Table 1 Table 1 次に著者は、(+)-1およびその誘導体の光学活性鍵合成中間体の効率的合成法の開発に取り組んだ。まず、27から導いた28を29とし、加水分解、脱炭酸させてdl-30を得た。dl-30を(S)-4-ベンジル-2-オキサゾリジノンと縮合させ、シリカゲルカラムクロマトグラフィーで分離して得たジアステレオマー(32)を還元、アセチル化後、ニトロ化して(+)-34を得た。一方のジアステレオマーである31は塩基性条件下で容易にエピメリ化し、31と32の混合物を与えた[Scheme 9、10]。  図表Scheme 9 / Scheme 10 図表Scheme 9 / Scheme 10 次に、さらに効率の良い光学分割法としてdl-35の光学分割を検討した[Scheme 11]。その結果、(S)-N-シンナモイルプロリンとdl-35のエステルが、再結晶で分離可能なジアステレオマー[(-)-36、37]を与えることを見い出し、低極性な(-)-36を純品の結晶として得た。(-)-36を加水分解、アセチル化して、(+)-34を得た。若干の(-)-36を含む高極性な37は、(-)-38とし、炭酸カリウムと処理して39に導いた。39はハイドロボレーション反応、続く酸化により、dl-35に誘導された。この結果、不要な37が効率良くdl-35にリサイクルできることとなった。 dl-30およびdl-35の光学分割によって得た(+)-3は、dl-3と同様に誘導して(-)-6が得られたことにより(S)配置であると決定した[Scheme 12]。  図表Scheme 11 / Scheme 12 図表Scheme 11 / Scheme 12 以上述べてきたように筆者は、1並びに15の全合成、および工業的にも充分実施可能な光学活性鍵合成中間体の効率的合成法の開発に成功した。現在、本研究によって得られた知見を応用してより優れた抗腫瘍活性を有する新規な非天然型デュオカルマイシン誘導体の探索に取り組んでいる。本研究が癌と闘う多くの人々の福音となる抗癌剤を提供することの基礎となれば望外の喜びである。 |