現在の動脈硬化症に対する治療の主流である各種血管形成術およびバイパス術に共通の最大の問題は再狭窄である。術後早期の再狭窄は、内膜、中膜の損傷に対する血栓付着、血管収縮、過伸展後のelastic recoilであるが、最大の問題となる再挟窄は術後3〜6カ月後に生じる遠隔期の再狭窄であり、術侵襲による血管壁損傷に反応した、中膜血管平滑筋の増殖による新生内膜形成が主要な一因と考えられている。これまでに様々な動物モデルを使用し数々の薬物に関して新生内膜抑制効果が検討されているが、platclct IIb/IIIa抗体以外には臨床的に有効とされたものはほとんど存在しない。この原因の一つには人間においては薬物全身投与による副作用を回避するための投与量減量の必要性と、それによる薬物局所濃度の低下が考えられる。本研究においては臨床応用可能なL-アルギニン、アンギオテンシン変換酵素阻害薬(ACE阻害薬)、アンギオテンシンII受容体拮抗薬(ATIR拮抗薬)を使用し、ラット頚動脈バルーン障害モデルにおける新生内膜抑制効果を検討するとともに、薬物局所投与治療の可能性についても検討を加えた。 第一章においてはnitric oxide(NO)の基質であるL-アルギニンの血管障害後の新生内膜増殖に対する効果を検討した。NOは内膜由来弛緩因子(EDRF)の本体であり、血管内皮細胞のNO合成酵素によりL-アルギニンから生成され、血管平滑筋細胞内でcGMPを増加させ、血管平滑筋を弛緩させる。またNOは血小板の凝集を抑制する。またNO donorの薬物および8-bromo-cGMPは培養血管平滑筋細胞の増殖を抑制し、L-アルギニンは高脂血症家兎モデルにおいて動脈硬化巣の進展を抑制する。最近Vanhoutteらはラット頚動脈バルーン障害モデルにおいて血管障害後6時間以降に血管壁でのNO合成酵素活性が誘導されることを示した。 我々はラット頚動脈バルーン障害モデルを使用し、L-アルギニンの全身+局所投与のみが新生内膜増殖を有意に抑制し、NO合成阻害薬であるN・ニトロレ・アルギニンメチルエステル(NAME)の全身投与が中膜を増大させることを示した(図1)。この時L-アルギニンの光学異性体でありNOの基質とならないD-アルギニンは新生内膜抑制効果を示さなかった。 NAME投与群では対照群に比較し有意に血圧が上昇しており(180±5 vs 146±2 mmHg)、NAMEが内因性NOの産生を充分に抑制していることを示していた。 また血管組織内cCMP濃度を測定したところ、バルーン障害後14日目の左頚動脈(再生内皮非被覆部位)では内皮剥離後の右頚動脈より有意に高く、正常右頚動脈とほぼ同等であり(それぞれ175±64.35±12.180±44 fmol/mg tissue)、このことは新生内膜におけるNO産生を支持するものと考えられた。 上記の事項よりL-アルギニンは誘導されたNO合成酵素によるNO産生をを介して、特に血管障害後早期の中膜における平滑筋細胞増殖に対して抑制的に働くと考えられた。 第二章においてはACE阻害薬のcaptopril(cap)及びdelapril(del)とATIR拮抗薬のDuP753(DuP)及びCVI1974(CV)を使用しラットバルーン障害モデルでの新生内膜増殖に対する効果を検討した。近年、血管組織における組織レニン-アンギオテンシン系の存在及びその新生内膜増殖過程に対する関与が指摘されている。ラットバルーン障害モデルにおけるcilazapriの新生内膜抑制効果がPowellらにより発表された後、PTCA後の再狭窄に対する臨床試験が施行されたが有効性は認められなかった。この理由の一つとして局所有効薬物濃度の問題が考えられる。 我々はまずACE阻害薬とATIR拮抗薬を全身投与し新生内膜抑制効果を見たところ、図2のように投与量に応じた有意な抑制効果が認められ、これは他の報告と同様なものであった。また図3に示すように、全身投与の場合同等の降圧効果ではACE阻害薬のほうがATIR拮抗薬より新生内膜抑制効果が強かった。 次に我々は両薬物をF127 pluronic gelに混入しバルーン障害直後に左総頚動脈上部2/3に直接塗布する方法で局所投与したところ、図4のように全身投与(5日間)+局所投与群のみならず単回局所投与群においても新生内膜増殖が有意に抑制された。 この単回局所投与群における抑制効果は血管障害後早期の中膜平滑筋細胞増殖に対する抑制効果を介するものと考えられる。このため我々はATIR拮抗薬(CVI1974)をバルーン障害直後に左総頚動脈上部1/3のみに局所投与し、薬物投与部位(遠位部/distal segment)と非投与部位(近位部/proximal segment)で障害後2日目における細胞増殖(5-ブロモ2’-デオキシウリジン(BrdU)陽性細胞率)を調べた。この結果図5のようにCVI1974 2mg投与群では遠位部におけるBrdU陽性細胞率が有意に減少しており、バルーン障害後2日目での薬物投与部位における中膜平滑筋細胞増殖が抑制されていることが確認された。 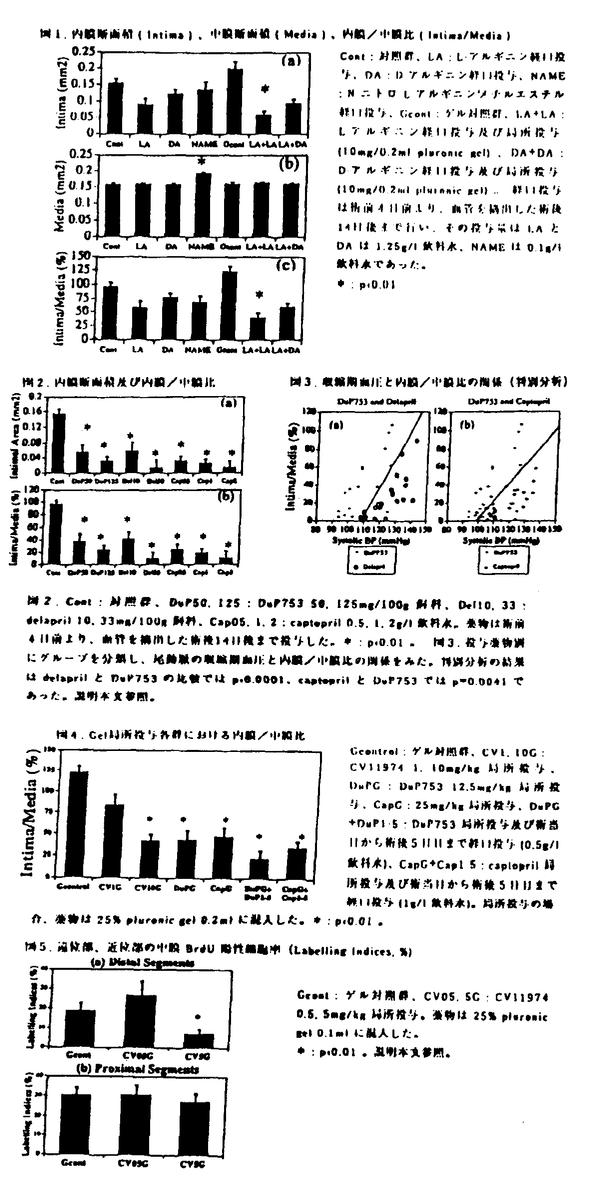 図表図1.内膜断面積(Intima)、中膜断面積(Media)、内膜/中膜比(Intima/Media) / 図2.内膜断面積及び内膜/中膜比 / 図3.収縮期血圧と内膜/中膜比の関係(判別分析) / 図4.Gel局所投与各群における内膜/中膜比 / 図5.遠位部、近位部の中膜BrdU陽性細胞率(Labelling Indices.%) 図表図1.内膜断面積(Intima)、中膜断面積(Media)、内膜/中膜比(Intima/Media) / 図2.内膜断面積及び内膜/中膜比 / 図3.収縮期血圧と内膜/中膜比の関係(判別分析) / 図4.Gel局所投与各群における内膜/中膜比 / 図5.遠位部、近位部の中膜BrdU陽性細胞率(Labelling Indices.%) また血管障害後の新生内膜増殖に対するATIR拮抗薬の効果に関して、その理想的な投与時期及び投与部位を検討するため、我々はin situハイブリダイゼーション法を用いて障害後血管におけるアンギオテンシン II type IA受容体のメッセンジャーRNA発現の経時的変化について調べた。その結果アンギオテンシン II type IA受容体のメッセンジャーRNAは、中膜平滑筋ではバルーン障害後2日〜4日目で発現が増強するもののその他の時期においては正常右頚動脈の中膜における発現と同等かそれ以下であった。新生内膜においては増殖初期のバルーン障害後7日目には全細胞に発現が強いものの、次第に減弱しバルーン障害後1ヵ月目には最も管腔側に近い細胞にのみ発現が限局されていた。外膜組織においては障害前より発現は強くバルーン障害後4日目には最大に増強し以降しだいに減弱した。 上記の結果をまとめると、ACE阻害薬とATIR拮抗薬の全身投与のみならず局所投与は血管障害後の新生内膜増殖を抑制すること、ATIR拮抗薬の局所投与は血管障害後早期の中膜平滑筋細胞増殖を抑制すること、障害後血管におけるアンギオテンシン II type IA受容体のメッセンジャーRNA発現の経時的変化のパターンよりアンギオテンシンIIは血管障害後早期の中膜・外膜および増殖初期の新生内膜に影響すると考えられ、ATIR拮抗薬は血管障害直後より新生内膜形成初期まで局所に投与するのが望ましいことが示唆された。 全体の総括としては、薬物の局所投与は全身大量投与による副作用を防止し且つ有効局所濃度を達成する意味で臨床応用に際し重要であると考えられ、その場合L-アルギニン、アンギオテンシン変換酵素阻害薬、アンギオテンシン II 受容体拮抗薬などは安全性有効性の面でよい薬物と考えられるが、有効局所濃度を必要期間だけ維持する投与方法の開発が今後重要であると考えられた。 |