| 1、緒言 リポ蛋白リパーゼ(LPL)はカイロミクロンや超低比重リポ蛋白(VLDL)といった中性脂肪に富むリポ蛋白粒子の異化を通して、血漿中の中性脂肪の代謝に中心的な役割を演じている酵素である。 既にLPL蛋白の検出・測定の為に、幾つかの特異抗体や酵素免疫抗体法(ELISA)が開発されているが、LPL分子の特定部分の選択的な検出や家族性LPL欠損症患者に見い出されるLPL変異体の検出などには不便であった。本研究ではこれらの問題点を克服するために、ヒトLPLのアミノ末端およびカルボキシ末端のそれぞれ16アミノ酸残基に相当する合成ペプチドと共に、ヒトLPL cDNAをチャイニーズハムスターの卵巣癌細胞(CHO-cell)に遺伝子導入を行い、ヒトLPLを分泌させたリコンビナントLPLを抗原として用い抗LPL抗体を作成し、LPL蛋白の測定系を開発した。 さらに、ヒトLPL過剰発現細胞(CHO-LPL)に加えてLPLアンチセンスcDNAの遺伝子導入細胞(CHO-antiLPL)を作成し、LPLによるアポリポ蛋白B-100を含むリポ蛋白代謝に及ぼす影響を検討した。 2、方法 1)細胞へのヒトLPL遺伝子の導入:ヒト胎盤由来のLPL1,581-bp cDNA断片をRc/CMVベクターにsenseおよびantisenseの方向にサブクローンし、CHO-K細胞に遺伝子導入を行った。同様に正常およびC末端を変異させたプラスミドをサブクローンし、RipofectinTM Reagentを用いてCos-1細胞に遺伝子導入した。 2)LPLの活性測定方法および精製:Nilsson-Ehle及びSchotzらの方法に準じ、水解反応により遊離した脂肪酸の放射活性を測定した。リコンビナントヒトLPLおよびbovine LPLの精製は、CHO-LPLの培養液、脱脂生乳をヘパリンーセファロースアフィニティカラムにかけて精製した。 3)4種のポリクローナル抗体の作成およびBovine LPLに対するモノクローナル抗体の作成:精製したLPL蛋白、ヒトLPLのN末端およびC末端に対応する16アミノ酸残基を合成しKLHを結合したペプチド抗原を日本白色家兎に免疫を行った。Bovine LPLはマウスに腹腔内投与し、脾臓細胞とミエローマ細胞の融合を行い、酵素免疫抗体法を用いてpositive cloneを単一クローン化した。 4)ELISA法によるLPL蛋白測定法の検討:ELISAプレートに10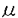 gIgG/ml濃度の第1次抗体をコーティングした。0.05%TritonX-100-PBS洗浄液にて洗浄、1%gelatinでブロッキング後、サンプルとELISA bufferを加え反応させた。5 gIgG/ml濃度の第1次抗体をコーティングした。0.05%TritonX-100-PBS洗浄液にて洗浄、1%gelatinでブロッキング後、サンプルとELISA bufferを加え反応させた。5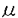 gIgG/ml濃度のビオチニル化第2次抗体を反応させ、streptoabidin-peroxidaseを加え、発色試薬にて波長492nmの発色強度を測定した。標準物質にはbovine LPLを用いた。 gIgG/ml濃度のビオチニル化第2次抗体を反応させ、streptoabidin-peroxidaseを加え、発色試薬にて波長492nmの発色強度を測定した。標準物質にはbovine LPLを用いた。 5)LPL transfectant CHO細胞のVLDLに及ぼす作用:CHO細胞とVLDLを37℃でincubatinし、培養液中のコレステロール、中性脂肪量の経時的および容量依存性の変化を酵素法にて測定した。培養液をdensitygradientによる超遠心を行い7分画に分離し、その脂質を測定した。リポ蛋白のゲルろ過にて粒子サイズの変化をみた。培養液を再度超遠心しVLDLを3〜20%gradientのSDS-PAGEにてアポ蛋白の変化を検討した。 6)Binding assay:ヨード化したリポ蛋白を培養液中に加え、37℃で5時間incubationし細胞への結合量と取り込み量を測定した。一方、4℃でのbindingの測定はヨード化リポ蛋白を4℃で2時間incubationして細胞表面に結合した125-Iリポ蛋白を測定した。またヘパリン処理後、同様のBinding assayを行った。 3、結果 1)In vitroにおけるCHO細胞へのヒトLPL遺伝子の導入:CHO-LPLはCHO-Kの約7倍のLPL活性を示した。Northern blot解析でCHO-LPLには約2.3kbの位置にバンドが観察されたが、CHO-Kではこのbandは欠き、ヒトLPLmRNAのシグナルと解釈した。CHO-LPLはヘパリン親和性を示す水解活性のピークがヘパリンセファロースカラムで1.6M-NaCl bufferの溶出画分にあり、アポリポ蛋白C-IIの添加により活性は増強した。SDS-PAGEではCHO-LPL細胞には1本のmajor bandが検出され、その分子量は約55600であった。Western blot分析では抗bovine LPL坑体により免疫学的に検出された。 2)LPL活性に及ぼす抗体の抑制効果:抗bovineおよび抗ヒトリコンビナントLPL抗体は濃度依存的にヒトのヘパリン静注後血漿(PHP)中のLPL活性を顕著に抑制し、抗C末端抗体は中等度に抑制したが、抗N末端抗体、モノクローナル抗体の4種混合では影響を及ぼさなかった。また、抗bovineと抗ヒトリコンビナントLPL抗体はヒトを含む多くの種のLPL活性を抑制したが、抗C末端抗体はヒトのみを抑制した。 3)ELISA法による測定系の確立:第1次抗体に抗N末端、抗C末端あるいは混合モノクローナル抗体を用い、第2次抗体にビオチニル化抗bovine LPLポリクローナル抗体使用の系が感度良い測定系であった。 4)C末端切断変異LPLの検出:培養液中の変異LPLを抗N末端、抗C末端抗体で測定した結果、抗C末端抗体はLPL-436は検出可能であったがLPL-434やLPL-435は不完全であり、433〜436残基の中に抗原認識部位を持つと考えた。Trp382の終末変異ホモ接合型LPL欠損症患者の血漿を抗N末端抗体を用いたLPL蛋白量は、22ng/mlという顕著な減少を示したが、混合モノクローナル抗体で28.6ng/ml、抗C末端抗体では0を示し、C末端が変異したLPL蛋白は存在するものの有意に低い値であることが確認され、抗体の有用性が示された。 5)センスおよびアンチセンスLPLcDNA遺伝子導入CHO細胞のLPL活性とLPL蛋白量:CHO-K、CHO-LPLおよびCHO-anti LPLの培養液中の活性は642、5004、242U/dayであり、細胞抽出液中は475、4696、284U/dayであった(1U=1nmol free fatty acid per hour per milligram cell protein)。また、LPL蛋白量は培養液中75、632、17ng/mg cell proteinで、細胞抽出液中は151、610および61であった。 6)VLDLの加水分解:VLDLをCHO-LPL細胞に加えた時、経時的に中性脂肪量は減少したが、CHO-anti LPLでは3%のみであった。8時間後ではCHO-anti LPLの33%にまで減少した。Density-gradientでは、CHO-LPLでd=1.005の画分の減少、d=1.017、d=1.029画分の増加が観察され、VLDLが加水分解されIDL(中間型リポ蛋白)の生じたことが示唆されたが、CHO-anti LPLでは有意な変化は認められなかった。高速液体クロマトグラフィを用いたゲルろ過では、CHO-LPLでVLDL粒子はより小さな粒子サイズを含む画分へ移動し、中性脂肪のピークは顕著な減少がみられた。SDS-PAGEおよびデンシトメーターによるスキャンニングでは、CHO-LPLではCHO-anti LPLと比較してVLDL中のアポE含量は多く、3.8倍を示した。 7)VLDLの細胞内への取り込み:正常人VLDLは、細胞結合量、細胞内取り込み量ともCHO-K、CHO-anti LPLに比べ、CHO-LPLでは4〜5倍を示した。高中性脂肪血症患者のVLDLでは、CHO-KとCHO-anti LPL間に約1.5倍の差が認められた。競合実験では、過剰のVLDLは完全にVLDLの取り込みを抑制したが、過剰のLDL(低比重リポ蛋白)では完全には抑制されなかった。アポE欠損症、E2/2の取り込みはCHO-LPLでは正常人の場合の12%、22%に過ぎず、CHO-anti LPLでは最小もしくは0であった。4℃での結合実験では、CHO-LPLはCHO-anti LPLの2.3倍を示したが、細胞をヘパリンで処理後では差の消失が観察され、細胞表面のLPLによる結合への関与が示唆された。逆にCHO-LPLの37℃での取り込みはCHO-anti LPLの4.1倍高かった。4℃でのヘパリン洗浄後のLDLの結合実験では差が見られなかったが、ヘパリン未処理の場合では2倍高い値を示した。 4、考察 LPL抗体の開発において、合成ペプチドを抗原として用いたのは本研究が初めての報告である。抗N末端抗体はLPL分子に対し親和性が高いにもかかわらず、LPL水解作用へ影響を及ぼさないことから、ヒトLPLの両端は酵素の活性中心から離れて存在すると予測された。ヒトLPLのN末端の1塩基置換(Asp9をAsnに置換)はLPL機能に影響を及ぼさないLohseらの報告から、N末端は酵素機能の発現に重要であるとは考えられない。一方、C末端領域は酵素の蛋白量、活性の発現と密接に関係しており、Val436の機能的な重要性を示唆したKozakiらの報告からもC末端は機能の発現に必須である。今回抗C末端抗体のLPL活性への著明な抑制はLPL分子のC末端の酵素機能発現における重要性を示している。抗C末端抗体の抗原認識部位が433-436アミノ酸残基中と推測されたが、Val436への効果を通じ活性を抑制したものと思われる。LPL両末端のいずれかと選択的に反応する本抗体はLPLの機能と構造との関係を調べる際に有用であった。 次に、ヒトLPLcDNA遺伝子導入した細胞系を確立しリポ蛋白代謝に与える影響を研究した。LPLにより加水分解されたVLDLの結合量の増加は2つの異なったメカニズムによって説明された。1)VLDLはCHO-LPLより分泌されるLPLにより中性脂肪が加水分解され、レムナントが産生され、相対的にアポE含量が増加してLDL受容体への親和性を増加させた。さらに、アポE欠損症患者のVLDLの取り込みの低さは、VLDLのLDL受容体による取り込みにおけるアポEの重要性を示した。従って、細胞から分泌されるLPLによるVLDLの加水分解や構造上の変化は、LDL受容体に依存した取り込み機構の1つと考えられた。2)過剰のLDLではCHO-LPL、CHO-anti-LPL共にVLDLの取り込みが完全に抑制されなかった。また、ヘパリン非存在下では、CHO-LPLにおけるVLDLの結合はCHO-anti-LPLに比べ有意に高いが、ヘパリン洗浄後では有意差を認めず、リポ蛋白の取り込みにおける、LDL受容体を介さないLPLによる仲介が示唆された。LPLはLDLやLp(a)のようなアポB-100に富むリポ蛋白と、細胞表面上のプロテオグリカンとの結合を促進してリポ蛋白の細胞内への取り込みを促進することが示唆されており、LDL受容体非依存経路によるVLDLの取り込みの一部を示しているのであろう。 本研究よりLPLは組織での脂質代謝の調節を司る多機能蛋白であり中性脂肪を加水分解する酵素の1つであると同時に、細胞表面のヘパラン硫酸プロテオグリカンとリポ蛋白を連結する橋渡しの役割をも担う蛋白であることを示した。嶋田らは、LPLを過剰発現したトランスジェニックマウスの食餌により惹起される高脂血症への抵抗性を認め、LPLが血漿中の中性脂肪のみならずコレステロール代謝をも調節すると報告している。従ってLPLはリポ蛋白中の中性脂肪の加水分解により血漿中性脂肪の値を規定するのみならず、血漿コレステロール値の決定に重要な働きをしていることが明らかであるが、これはLPLがアポB-100を含んだリポ蛋白の細胞内への取り込みを促進する結果と考えられた。 |