アクチビンはインヒビンの精製過程においてブタ卵胞液中から発見された物質である。インヒビンは,ラットの下垂体前葉からのfollicle stimulating hormone(FSH)の分泌抑制因子であるが,これに対しアクチビンはFSH分泌促進作用を有することが知られている。インヒビンはFSH分泌促進等の下垂体-性腺系に対する作用以外には注目すべき生理作用は知られてないが,アクチビンは両生類の中胚葉誘導作用や神経芽細胞,骨芽細胞の分化等,生体内に幅広く分布し多彩な生理活性を持つことから,ホルモン調節物質というより細胞分化の調節因子として注目されている。またアクチビンはヒト単球性白血病細胞の培養液中から発見された赤芽球分化誘導因子(EDF:erythroid differentiation factor)と同一分子であり,骨髓でも産生されることが判明した。 さらに卵胞液中にはインヒビン同様にFSH分泌を抑制するフォリスタチンが存在することが発見された。フォリスタチンは生体内に広く分布しており,後にアクチビンのbinding proteinであることが判明した。 一方,卵胞の発育や成熟は間脳-下垂体-卵巣調節機構により制御されていることが知られているが,この調節機構だけでは説明できない種々の現象を認め,近年では卵巣局所における卵の成熟・発育に働く局所因子が注目されている。インヒビン・アクチビン・フォリスタチンは卵巣局所に存在し卵胞発育を制御する因子として働いていると考えられる。卵胞発育過程におけるこれらの物質の作用を理解することは,臨床上で排卵誘発や体外受精を扱う場合に有用である。 本研究ではアクチビンの生殖生理における役割について,実験1ではヒト卵胞液中におけるアクチビンの存在を確認し,実験2では動物実験モデルを用いて卵成熟過程におけるアクチビンの作用を明らかにすることを目的とした。 実験1では,当科で体外受精を受けた13人の患者の94卵胞から患者の同意のもとに卵胞液を採取した。得られた卵胞液中のアクチビン活性はマウスフレンド白血病細胞を用いたbioassay法で測定した。活性がアクチビンに特異的なものであるかどうかは,アクチビンのbinding proteinであるフォリスタチンを同時添加し活性が中和されることにより確認した。 標準アクチビンA0.8-25ng/mlをフレンド細胞に添加した際のヘモグロビン合成細胞の割合(%)は用量反応的に増加した。一方,標準アクチビンA0.8-25ng/mlに未処理の卵胞液20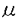 lを添加すると,卵胞液の添加によりアクチビン活性は完全に抑制された。また,未処理の卵胞液をフレンド細胞に添加した際にはアクチビン活性は認められなかった。そこで,卵胞液を精製しEDF活性をみたところ,精製後の卵胞液は標準アクチビンAと同様に用量反応的にヘモグロビン陽性細胞を増加した。これに100ngのフォリスタチンを添加すると活性は完全に抑制された。 lを添加すると,卵胞液の添加によりアクチビン活性は完全に抑制された。また,未処理の卵胞液をフレンド細胞に添加した際にはアクチビン活性は認められなかった。そこで,卵胞液を精製しEDF活性をみたところ,精製後の卵胞液は標準アクチビンAと同様に用量反応的にヘモグロビン陽性細胞を増加した。これに100ngのフォリスタチンを添加すると活性は完全に抑制された。 次にヒト卵胞液中に存在するアクチビン活性と卵胞液量,ステロイドホルモン濃度,発育卵胞数等のパラメーターとの相関を検討した。フォリスタチン除去後の卵胞液中のアクチビン活性の平均は43.2ng/mlであった。卵胞液処理後のアクチビン回収率は33%であることから,未処理の卵胞液中のアクチビン濃度は131±40ng/mlに相当する。 アクチビン濃度と卵胞液量およびエストラディオール,プロゲステロン濃度,または得られた卵の成熟度との間には有意な相関を認めなかった。一方,発育卵胞数とアクチビン濃度との間には有意な負の相関を認めた(r=-0.501;p<0.01)。発育卵胞数により患者を分類したとき,発育卵胞数の少ない群(<8)に比し発育卵胞数の多い群(8≧)のアクチビン濃度は有意に低かった(p<0.01)。 実験2では,23-25日令のWistar系幼若雌ラットより卵丘卵コンプレックス(cumulus-oocyte complex;COC)および卵丘細胞除去卵(denuded oocyte;DO)を得て一部は培養に,一部はmRNAの抽出に供した。 培養群は,COCを用いてmBWW培養液中に各種薬剤を添加して37℃,5%CO2,95%airの条件下に1ないし2時間培養した。培養後に卵丘細胞を除去し卵核の有無を観察した。卵の成熟は卵核崩壊を指標として評価した。 PMS投与後48時間後に成熟卵胞から採取したCOCを培養液中で1時間培養すると35.8%の卵に核の成熟(卵核崩壊)を認めた。成熟途上にある卵においても減数分裂の再開は観察されるが,PMS投与後24時間後および36時間後に採取した卵の卵核崩壊の割合は15.9%および17.8%と有意に低かった。アクチビンAは10ng/mlで卵の成熟に促進的に働くが,この作用は,PMS投与後24時間後ないし36時間後に未熟な卵胞から採取した卵においてより著明にみられた。また,アクチビン濃度各0.01,0.1,1ng/mlの添加によりGVBD率は用量反応的に上昇し,1ng/ml以上の添加では,有意に卵成熟が促進された。 次にこの成熟促進効果がアクチビンに特異的なものであることを確認するために,アクチビンのbinding proteinであるフォリスタチンを同時に添加し,培養を行った。無添加対照群のGVBD率が15.9%に対し,アクチビン10ng/mlの添加により1時間の培養後のGVBD率は31.7%(n=55)に上昇した。一方,フォリスタチン10ng/mlないし30ng/mlを同時添加するとGVBD率は各々18.3%(n=44),11.7%(n=60)と低下しアクチビンの作用は消失した。またフォリスタチン10ng/mlを単独添加した場合,1時間の培養では14.3%(n=42)と無添加対照群とほぼ同程度であったが,2時間の培養では28.9%と対照群に比して有意に低下した。 一方mRNA抽出群では,PMS処理ラットから得られたCOCおよびDOを各100個集めmRNAを抽出した。得られたmRNAをRT-PCR法で検討すると,アクチビン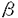 A鎖およびアクチビンレセプターの発現を認めた。 A鎖およびアクチビンレセプターの発現を認めた。 実験1より我々はヒト卵胞液中にリコンビナントアクチビンAと同様の生物活性を持つアクチビン様物質の存在を確認した。精製された卵胞液は標準アクチビン同様に,用量反応的にフレンド細胞の分化を誘導した。さらに,その作用がフォリスタチンにより消失する事からアクチビン様の活性を持つ物質の存在が確認された。しかし興味深いことには,相当量のアクチビン様物質が存在しているにも関わらず,精製していない卵胞液ではアクチビン活性はほとんど認められない。未処理の卵胞液を標準アッセイ系に添加すると,アクチビン活性は抑制される。これらの結果はヒト卵胞液がアクチビンの特異的な抑制因子,すなわちフォリスタチンを多量に含有していることを示唆する。ヒト卵胞液中のアクチビン活性の濃度は,同様のアッセイ系から求められた血清中のアクチビン濃度の約100倍も高い。従ってアクチビンはヒトにおいても他の種の動物と同様に卵巣で産生されることが示唆される。アクチビンが卵胞液中に高濃度に存在することは,この物質がアクチビンレセプターを持つ顆粒膜細胞のような卵胞の細胞にオートクライン・パラクライン的に働く可能性を示唆している。 また実験2からアクチビンAがラットのCOCにおいて核成熟を促進し,その作用はフォリスタチンにより抑制されることが分かった。卵におけるアクチビンの促進的な作用は,PMS投与後24ないし36時間という卵胞が発育途上にある際に有意に明らかであった。アクチビンAは,本来FSH刺激により生じる減数分裂再開の過程にパラクライン因子として働いている可能性がある。 アクチビンの結合蛋白と考えられているフォリスタチンは10ng/mlの濃度で同量のアクチビンの作用をほぼ完全に抑制した。フォリスタチンは同量のアクチビンに結合し,ラットの顆粒膜細胞でのステロイド産生に対するアクチビンの作用を中和する。これはフォリスタチンがアクチビンとレセプターとの結合を競合する事によるものと考えられている。同様の機序によりフォリスタチンはCOCにおいても抑制的な作用を持つものと思われる。興味深いことにフォリスタチンは単独でも卵の核成熟を抑制する。この結果からアクチビンは顆粒膜細胞以外にCOCでも産生される可能性が考えられる。 我々は初めて哺乳動物の卵にアクチビンレセプターの遺伝子が発現することを示した。卵胞液中に存在するアクチビンは卵のレセプターを介して卵の成熟に直接的に働くと考えられる。本研究において我々はアクチビン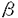 A鎖の遺伝子がCOCないし卵そのものにも発現することもまた明らかにした。卵胞液中に存在するアクチビンは卵のレセプターを介して卵の成熟に直接的に働くと考えられる。 A鎖の遺伝子がCOCないし卵そのものにも発現することもまた明らかにした。卵胞液中に存在するアクチビンは卵のレセプターを介して卵の成熟に直接的に働くと考えられる。 これらの結果はアクチビンがフォリスタチンの作用とのバランスのもとに顆粒膜細胞に囲まれた卵卵丘細胞で産生され,卵の発育ないし成熟ひいては受精能の獲得という機序において重要な役割を果たしていることを示唆するものである。 |