Calcitonin gene-related peptide(CGRP)は37個のアミノ酸よりなる神経ペプチドで、コードする遺伝子はcalcitonin遺伝子と同一であるが、異なったmRNAのsplicingを介して産生される。中枢および末梢神経系に豊富に存在し、哺乳類の皮膚における主要な神経ペプチドの一つに位置づけられる。皮膚への刺激等に対応して、主に軸索反射により知覚神経から放出されるが、強い血管拡張作用を有し、いわゆるneurogenic inflammationに関与する炎症起因物質とされている。さらに近年、CGRPには、substance P(SP)やvasoative intestinal peptide(VIP)など他の神経ペプチドと同様に、種々の免疫担当細胞に対する機能修飾作用のあることも明らかとなっており、T細胞の増殖反応やIL-2産生の抑制、マクロファージ(macrophage,M )のエフェクター機能の抑制などが知られる。我々は、以前に、マウス表皮のランゲルハンス細胞(Langerhans cell, LC)の抗原呈示能がCGRPによって抑制されることを複数の実験系を用いて証明した。解剖学的にも、ヒト表皮でCGRPを含有する神経線維が表皮内に侵入してLCと接触する像が認められ、またLCの約10%では、その表面にCGRPが陽性に染色されたことから、両者の密接な関係が示唆された。 )のエフェクター機能の抑制などが知られる。我々は、以前に、マウス表皮のランゲルハンス細胞(Langerhans cell, LC)の抗原呈示能がCGRPによって抑制されることを複数の実験系を用いて証明した。解剖学的にも、ヒト表皮でCGRPを含有する神経線維が表皮内に侵入してLCと接触する像が認められ、またLCの約10%では、その表面にCGRPが陽性に染色されたことから、両者の密接な関係が示唆された。 したがって、神経系と免疫系の接点の一つとして、CGRPによるLCの機能制御を介した皮膚免疫応答の修飾の可能性が考えられたが、in vivoにおけるその直接的証拠は、現時点では無い。今回、その仮説をさらに検証する目的で、マウスを用いた遅延型過敏症(Delayed-type hypersensitivity,DTH)および接触過敏症(Contact hypersensitivity,CHS)のモデルにおいて、その反応の出発点である感作相(sensitization phase)におけるCGRPの効果を検討した。まず、マウスspindle cell tumorであるS1509a細胞(H-2a)より調整し可溶性腫瘍関連抗原(Tumor-associated antigens,TAA)に対するDTHの実験系(in vitro/in vivo混合系)で、TAAでパルスしたLCを用いて感作および惹起を行った。この系では、S1509a細胞のTAAに対して感作が成立するためには、感作に用いる表皮細胞(Epidermal cell,EC)をGM-CSFにて処理する必要がある。ECのサスペンジョンをCAF1(H-2d/a)マウスより調整し、Thy-1陽性細胞を抗体-補体処理によって除去してLCの比率を高め、50U/mlGM-CSFとともに16時間培養し、実験群では同時に100nM CGRP Iを加えた。培養後のECをTAAでパルスし、洗浄後に未感作CAF1マウスに皮下注射して感作に用いた。この感作の操作を1週間の間隔で3回繰り返した後に、左足底にTAAでパルスしたECを皮下注射することによってDTHを惹起し、24時間後の足の腫脹を測定した。その結果、ECを感作相でCGRP処理することによってDTHの感作誘導が有意に抑制され、惹起相(elicitation phase)におけるDTHの反応低下が観察された。また、CGRP8-37はCGRP分子C末端の7個のアミノ酸を欠いたCGRP受容体アンタゴニストであるが、CGRPの生理活性を持たないためコントロールとして用いたところ、同濃度で抑制を認めなかった。一方、ハプテンに対するCHSの系では、感作相におけるin vivoのCGRP投与の効果をみるため、TNCBまたはDNFBをマウス左耳介後面に塗布して感作させるその8時間前、3時間前の2回、530pmolのCGRP Iまたはその溶媒のみ(コントロール)を50 lの容量でハプテン塗布部位に皮内注射した。1週間後に右耳介に同一ハプテンを塗布してCHSを惹起し、24時間後の耳介腫脹を測定した。皮内注射されたCGRP Iは、DTHの場合と同様、このCHSの感作を抑制したが、コントロールとして用いたcalcitoninは抑制能を持たなかった。CGRP Iの用量を0-530pmolの間で設定し、同様に皮内注射したところ、CHSの感作抑制はCGRP Iの用量依存性に認められた。さらに、ハプテン塗布部位と同じリンパ還流域と考えられるが、塗布部位から5-10mm離れた右耳介基部にCGRP Iを皮下注射した場合には、CHSの抑制は認められず、CGRPが注射局所の表皮内LCに作用することが示唆された。以上2つの実験系により、CGRPによる遅延型反応の感作相の特異的抑制が示され、その機序にはLCの抗原呈示能の抑制が想定された。また、DTHの実験系では感作成立のためにECのGM-CSF処理が必要であり、CGRPがGM-CSFの存在下でも抑制作用を有することが確認された。 lの容量でハプテン塗布部位に皮内注射した。1週間後に右耳介に同一ハプテンを塗布してCHSを惹起し、24時間後の耳介腫脹を測定した。皮内注射されたCGRP Iは、DTHの場合と同様、このCHSの感作を抑制したが、コントロールとして用いたcalcitoninは抑制能を持たなかった。CGRP Iの用量を0-530pmolの間で設定し、同様に皮内注射したところ、CHSの感作抑制はCGRP Iの用量依存性に認められた。さらに、ハプテン塗布部位と同じリンパ還流域と考えられるが、塗布部位から5-10mm離れた右耳介基部にCGRP Iを皮下注射した場合には、CHSの抑制は認められず、CGRPが注射局所の表皮内LCに作用することが示唆された。以上2つの実験系により、CGRPによる遅延型反応の感作相の特異的抑制が示され、その機序にはLCの抗原呈示能の抑制が想定された。また、DTHの実験系では感作成立のためにECのGM-CSF処理が必要であり、CGRPがGM-CSFの存在下でも抑制作用を有することが確認された。 一方、LCに対してCGRPが直接的に作用することを示すデータがないため、次に、CGRPに対する特異的受容体がLCに存在することの証拠を得ようと試みた。CGRPの膜受容体はGs蛋白に結合し、adenylate cyclaseが活性化されてセカンドメッセンジャーであるcAMPの産生が誘導されると考えられており、種々の標的細胞において、CGRPによる刺激後に細胞内cAMP産生ないしはadenylate cyclaseの活性化が観察されている。しかるに、LCにおいては、CGRPをはじめ他のいかなる化学伝達物質においても、cAMP等のセカンドメッセンジャーをLCにおいて測定した報告はみられない。そこで、密度勾配遠心法およびIa抗原を標的としたマグネティックビーズ法を用いてBALB/cマウスECからLCを高純度で精製し、85-90%の高純度のLCを得て、CGRP添加後の初期反応としての細胞内cAMP濃度の測定を試みた。その結果、100pM-1 MのCGRP I添加によってLC内のcAMP濃度は濃度依存性に著明に増加し、100nMにおける増加は、CGRP受容体のアンタゴニストであるCGRP8-37を100倍量(10 MのCGRP I添加によってLC内のcAMP濃度は濃度依存性に著明に増加し、100nMにおける増加は、CGRP受容体のアンタゴニストであるCGRP8-37を100倍量(10 M)まで同時に加えることにより濃度依存性に抑制された。さらに、比較として用いたSPやcalcitoninでは細胞内cAMPは誘導されなかったが、VIPではCGRP Iと同等のcAMPの誘導を認めた。LCを同一条件下でケラチノサイト(keratinocyte,KC)や腹腔内M M)まで同時に加えることにより濃度依存性に抑制された。さらに、比較として用いたSPやcalcitoninでは細胞内cAMPは誘導されなかったが、VIPではCGRP Iと同等のcAMPの誘導を認めた。LCを同一条件下でケラチノサイト(keratinocyte,KC)や腹腔内M と比較した際、CGRP IによるcAMPの誘導は、LCにおいて最も著明にみられた。以上の結果は、LCにCGRPに対する特異的受容体の存在することを示唆し、表皮内でCGRP含有神経線維がLCと接触する所見と矛盾しない。 と比較した際、CGRP IによるcAMPの誘導は、LCにおいて最も著明にみられた。以上の結果は、LCにCGRPに対する特異的受容体の存在することを示唆し、表皮内でCGRP含有神経線維がLCと接触する所見と矛盾しない。 さらに、LCに対するCGRPの抗原呈示抑制作用が実際に受容体を介する作用であるか、また、その作用がセカンドメッセンジャーとしてのcAMP誘導のみで説明可能であるかどうかの検討を、2種の実験系を用いて調べた。A/JマウスのEC(LC)がTh1 clone cellであるA.E7に特異抗原のpigeon cytochrome cを呈示するin vitroの系では、ECを100nM CGRP Iで前処理することによりA.E7細胞の反応性増殖が抑制された。また、TAAに対するDTHをみる上記のin vitro/in vivo混合系では、惹起相にて検討し、TAA感作マウスの足底にTAAでパルスしたEC(LC)を皮下注射してDTHを惹起したが、ECをパルス前に100nM CGRP Iで3時間前処理することによってDTHが抑制された。このいずれの実験系でも、100倍量(10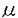 M)のCGRP8-37をCGRP Iと同時投与することによってその抑制作用がプロックされたが、これは、LCに対するCGRPの作用が特異的受容体を介することを示唆する。また、非特異的な細胞内cAMP誘導をもたらす1 M)のCGRP8-37をCGRP Iと同時投与することによってその抑制作用がプロックされたが、これは、LCに対するCGRPの作用が特異的受容体を介することを示唆する。また、非特異的な細胞内cAMP誘導をもたらす1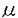 M forskolinを用いてECを処理したところ、LCの細胞内cAMP濃度が100nM CGRP Iと同等以上に上昇することが確認されているにもかかわらず、いずれの系でも反応の抑制が起きなかった。すなわち、cAMPのみではCGRPの抗原呈示抑制作用の再現ができず、CGRPによる同作用には、少なくともcAMP系以外のシグナル伝達機構も関与することが示された。 M forskolinを用いてECを処理したところ、LCの細胞内cAMP濃度が100nM CGRP Iと同等以上に上昇することが確認されているにもかかわらず、いずれの系でも反応の抑制が起きなかった。すなわち、cAMPのみではCGRPの抗原呈示抑制作用の再現ができず、CGRPによる同作用には、少なくともcAMP系以外のシグナル伝達機構も関与することが示された。 最後に、CGRPによる抗原呈示能抑制の機序を知る一つの手掛かりとして、co-stimulatory moleculeとして重要なB7-2分子の発現誘導に対するCGRPの効果を、newborn BALB/cマウス表皮由来のLC line XS52と、BALB/cマウス腹腔内M を用いて検討した。いずれの場合も、Lipopolysaccharide(LPS)により活性化、誘導されたB7-2分子の発現が、同時に加えた100nM CGRP Iによって抑制された。Ia分子発現はほとんど修飾されず、またcalcitoninやforskolinによるB7-2分子発現の変化もみられなかった。このB7-2発現の抑制は、CGRPによる抗原呈示能の抑制作用の機序の一つであると考えられた。 を用いて検討した。いずれの場合も、Lipopolysaccharide(LPS)により活性化、誘導されたB7-2分子の発現が、同時に加えた100nM CGRP Iによって抑制された。Ia分子発現はほとんど修飾されず、またcalcitoninやforskolinによるB7-2分子発現の変化もみられなかった。このB7-2発現の抑制は、CGRPによる抗原呈示能の抑制作用の機序の一つであると考えられた。 以上の一連の実験結果より、表皮LCの機能が内因性のCGRPによって直接に制御され、抗原呈示能の抑制を介して皮膚の遅延型反応の感作や惹起が抑制されることが示された。とくに、in vivoの実験系における感作の抑制の証明は、それが生体内における免疫反応の成立、不成立を左右する大切な局面であるため、その役割の重要性を強く示唆した。さらに、以前より指摘されながらもその理論的根拠の得られなかった、知覚神経線維の有する免疫抑制作用には、CGRPが関与することが初めて明らかにされた。CGRPによる、こうした免疫反応の制御は、生体内における過剰反応を抑える恒常性維持の手段の一つととらえられる。また、今回の知見は、CGRPやその誘導体が、免疫修飾作用を有する試薬として何らかの臨床応用ができる可能性も示した。 |