Epstein-Barr virus(EBV)は、成人では非感染者がまれであるほど広く普遍的に存在するウィルスである一方、in vitroでリンパ球をtransformしたり悪性リンパ腫、バーキットリンパ腫、上咽頭癌の原因となるなど発癌ウィルスとしての性格を持つ。しかし通常は、初感染で起こる伝染性単核球症(infectious mononucleosis:IM)あるいは不顕性初感染の際に、EBVに対する生体の免疫防御能が強力に成立して癌原性を制御するため、以後EBVは終生にわたり持続性不顕性感染として何ら症状を呈することなく体内に潜伏すると考えられる。EBV関連腫瘍の多くは、生体の免疫能が何らかの原因で低下した際に、潜伏EBVが再活性化されたり癌化の機序が働いたりして発症すると考えられる。このように、EBVに対する免疫反応は非常に重要であるが十分に解明されていない。そこでIMで増加しているリンパ球を詳細に解析することによりEBVに対する感染防御機構の一端を解明することを目的に、特にその活性化に注目してphenotypeおよび形態的異型性との関連、CD8+およびCD4+リンパ球について活性化マーカーの発現(HLA-DR,CD45isoform),リンパ球の細胞内pH(pHi)、血中可溶性CD8,CD4(soluble CD8,soluble CD4:以下sCD8,sCD4)およびそれら相互の関連と回復過程における推移、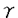 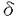 T細胞について検討した。 T細胞について検討した。 急性期IMの末梢血リンパ球は、CD8+リンパ球の比率および絶対数の著明な増加を認めた(70.1±9.3% vs 30.2±4.5%,p<0.0001、5246±3538/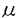 l vs 645±290/ l vs 645±290/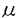 l,p<0.0001)。CD4+リンパ球とCD19+Bリンパ球は、比率は減少しているが絶対数では増減を認めなかった。増加しているCD8+リンパ球の主体はCD8+-CD11b-リンパ球で、正常に比べ活性化抗原であるHLA-DR、memory T cellのマーカーであるCD45ROの陽性率が著明に高値であった(HLA-DR76.0±13.5% vs 5.5±0.7%,p<0.0001;CD45RO82.4±11.6% vs 24.2±6.1%,p<0.0001)。CD45のisoformについては、CD45RAがnaive Tの、CD45ROがmemory Tのマーカーとされ、はじめは両者はreciprocalとされてきたが、IMでは正常人末梢血にはわずかしか存在しないCD45RO+CD45RA(dim)+細胞の著明な増加が特徴的であった。最近、刺激されたリンパ球がCD45RA+からCD45RO+に移行する際に一過性にCD45RA+CD45RO+の段階を経ると考えられるようになった。IM末梢血ではEBV感染Bリンパ球に対してCD8+リンパ球が急速に増加、活性化されるためこのような移行途中の細胞が目立っている可能性がある。 l,p<0.0001)。CD4+リンパ球とCD19+Bリンパ球は、比率は減少しているが絶対数では増減を認めなかった。増加しているCD8+リンパ球の主体はCD8+-CD11b-リンパ球で、正常に比べ活性化抗原であるHLA-DR、memory T cellのマーカーであるCD45ROの陽性率が著明に高値であった(HLA-DR76.0±13.5% vs 5.5±0.7%,p<0.0001;CD45RO82.4±11.6% vs 24.2±6.1%,p<0.0001)。CD45のisoformについては、CD45RAがnaive Tの、CD45ROがmemory Tのマーカーとされ、はじめは両者はreciprocalとされてきたが、IMでは正常人末梢血にはわずかしか存在しないCD45RO+CD45RA(dim)+細胞の著明な増加が特徴的であった。最近、刺激されたリンパ球がCD45RA+からCD45RO+に移行する際に一過性にCD45RA+CD45RO+の段階を経ると考えられるようになった。IM末梢血ではEBV感染Bリンパ球に対してCD8+リンパ球が急速に増加、活性化されるためこのような移行途中の細胞が目立っている可能性がある。 IMで特徴的な異型リンパ球とphenotypeの関係をflow cytometerを用いたsortingで検討すると、CD8+CD11b-細胞中に異型リンパ球がenrichされる(64.3±11.2% vs 72.2±11.9%)が、CD4+リンパ球、CD19+Bリンパ球中にも異型リンパ球が少数ながら存在することが示された(4-13%)。 次に、リンパ球の活性化に伴ってリンパ球から遊離することが知られる血中可溶性リンパ球抗原について検討した。IM急性期の血漿sCD8(mean±SE)は、22366±2702U/mlと正常人(219±10U/ml)の平均約100倍という著明な増加を示し、IMにおけるCD8+リンパ球の活性化が示唆された。このような著明なsCD8増加は他の疾患では報告がなく、IM診断の一助にもなると思われた。sCD8値は末梢血中のCD8+リンパ球数およびCD8+-HLA-DR+リンパ球の比率や絶対数との間に強い相関を認めた。さらに血中sCD8(U/ml)/末梢血CD8+リンパ球数(/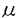 l)の比がIMでは上昇していること(4.8±0.4 vs 0.41±0.05,p<0.0001)、IMの末梢血リンパ球をin vitroで培養すると、リンパ球106あたりから放出されるsCD8(U/ml)が正常人リンパ球にくらべ多い(1330±436vs118.2±46.5,p<0.01)ことより、IMにおけるsCD8の著明な上昇は、CD8+リンパ球の増加とともに個々のリンパ球からのsCD8放出の増加によることが示された。さらにin vitroで培養したリンパ球について経時的に検討すると、sCD8放出は培養開始後0-3時間の間がピークで、apoptosis(6-12時間後がピーク)による細胞の死滅より早期に起こることがわかった。 l)の比がIMでは上昇していること(4.8±0.4 vs 0.41±0.05,p<0.0001)、IMの末梢血リンパ球をin vitroで培養すると、リンパ球106あたりから放出されるsCD8(U/ml)が正常人リンパ球にくらべ多い(1330±436vs118.2±46.5,p<0.01)ことより、IMにおけるsCD8の著明な上昇は、CD8+リンパ球の増加とともに個々のリンパ球からのsCD8放出の増加によることが示された。さらにin vitroで培養したリンパ球について経時的に検討すると、sCD8放出は培養開始後0-3時間の間がピークで、apoptosis(6-12時間後がピーク)による細胞の死滅より早期に起こることがわかった。 次に、細胞の活性化との関連が示唆されるpHiを検討した。蛍光pH指示薬BCECFと蛍光分光光度計を用いた従来のpHi測定法では、細胞浮遊液全体の蛍光を測定するので、特定のリンパ球サブセットのpHiを測定することはできない。そこで、flow cytometerを用いてサブセットごとのpHiを測定する方法を確立した。まず、リンパ球を10-7MのBCECF-AMとともに37℃で30分incubateしその後PE標識抗体で細胞表面抗原を染色し、flow cytometerでcompensationを調整してtwo color分析を行った。蛍光強度からpHiの絶対値を求めるcalibrationはnigericin/K+法を用いてサブセットごとに行った。これにより、IM末梢血リンパ球のpHiについても詳細な検討が可能になった。CD8+リンパ球のpHiは7.35±0.07と正常人(7.18±0.05)に比べ著明に上昇し(p<0.0001)、CD8+-HLA-DR+リンパ球の絶対数および血漿sCD8と相関を認めた。 以上の所見よりIMで著増しているCD8+リンパ球の活性化が示唆された。CD8+リンパ球はHLA非拘束性cytotoxic T cell,ウィルス特異的HLA拘束性cytotoxic T cell,EBV感染Bリンパ球の増殖を抑制するsuppressorT cellなどを含むと思われ、EBV感染防御に最も強力に働いているサブセットと考えられる。 CD4+リンパ球についてもHLA-DRやCD45ROの陽性率上昇(HLA-DR33.0±10.4% vs 4.3±1.8%;CD45RO59.9±12.1% vs 44.2±6.5%)、血漿sCD4の増加(19.3±0.9U/ml vs 8.1±0.2U/ml mean±SE)、pHi上昇(CD8-リンパ球のpHiとして測定し、経過中のピーク値で7.29±0.10 vs 7.19±0.04)を認めた。しかしそれぞれの変化の程度はCD8+リンパ球の場合より軽度で、pHiは初回測定後pHiが上昇し第20-38病日にピークになりその後低下する例が多いことがCD8+リンパ球とは異なっていた。CD4+リンパ球もIMにおいて数は増加していないが活性化され、EBV感染防御に何らかの役割を果たしている可能性が示唆された。その役割は十分解明されていないが、cytotoxic T cellのinducer,Bリンパ球活性化に働くhelper T cell,CD4+ cytotoxic T cellなどを含むと思われる。 次に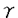 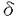 T細胞について検討した。比率で7.9±4.7%,絶対数で596±599/ T細胞について検討した。比率で7.9±4.7%,絶対数で596±599/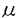 1と正常(3.4±1.6%,68±44/ 1と正常(3.4±1.6%,68±44/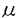 1)に比べ増加していた。 1)に比べ増加していた。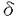 TCS1陰性、Ti TCS1陰性、Ti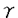 A1陽性の胸腺外タイプの A1陽性の胸腺外タイプの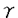 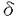 T細胞が多く、CD4-CD8-のものが多かったが、CD8+(dim)の細胞も平均27.6%認められた。通常の T細胞が多く、CD4-CD8-のものが多かったが、CD8+(dim)の細胞も平均27.6%認められた。通常の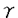 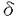 T細胞ではCD4-CD8-の細胞が多いが、in vitroでIL-2で活性化された T細胞ではCD4-CD8-の細胞が多いが、in vitroでIL-2で活性化された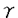 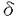 T細胞がCD8を発現するとの報告もあり興味深い。またHLA-DRの陽性率が増加(93.0±5.2% vs 31.1±16.0%)し、CD45 isoformではCD45RA-CD45RO+,CD45RA+CD45RO+のものが増加していた。これらからEBV感染防御においても活性化された T細胞がCD8を発現するとの報告もあり興味深い。またHLA-DRの陽性率が増加(93.0±5.2% vs 31.1±16.0%)し、CD45 isoformではCD45RA-CD45RO+,CD45RA+CD45RO+のものが増加していた。これらからEBV感染防御においても活性化された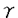 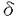 T細胞が何らかの役割を果たしていると思われた。 T細胞が何らかの役割を果たしていると思われた。 次に回復期における変化を検討した。発熱、リンパ節腫脹、肝障害、リンパ球増加などの臨床所見は遅くとも2か月以内にほぼ100%消失するが、今回検討したリンパ球活性化のパラメーターはこの時期を越えて遷延するものが多いことが特徴的であった。CD8+リンパ球数は35-44病日まで正常より有意に高値であり、pHiは第30-60病日ころ正常化した。しかしCD8+-HLA-DR+リンパ球数、CD8+リンパ球のCD45RO陽性率、血漿sCD8は第90病日以降も高値が持続した。CD4+リンパ球についても、CD4+-HLA-DR+リンパ球数は35-44病日まで高値でありpHiは30-60日で正常化したが、血漿sCD4は90-114病日でもまだ正常より高値であった。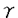 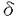 T細胞数増加およびそのHLA-DR,CD45ROの陽性率上昇も他の臨床所見が改善した8週以降も遷延した。EBVは初感染後数ヵ月にわたって唾液腺組織からsheddingされることが報告されており、これによってEBV感染防御に働く細胞の活性化が持続している可能性がある。 T細胞数増加およびそのHLA-DR,CD45ROの陽性率上昇も他の臨床所見が改善した8週以降も遷延した。EBVは初感染後数ヵ月にわたって唾液腺組織からsheddingされることが報告されており、これによってEBV感染防御に働く細胞の活性化が持続している可能性がある。 以上の検討より、EBVの初感染であるIMではCD8+リンパ球、CD4+リンパ球、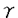 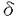 T細胞が急性期から回復期まで長期にわたって活性化され、感染防御に働いていると考えられた。 T細胞が急性期から回復期まで長期にわたって活性化され、感染防御に働いていると考えられた。 |