学位論文要旨
| No | 212939 | |
| 著者(漢字) | 服部,光治 | |
| 著者(英字) | ||
| 著者(カナ) | ハットリ,ミツハル | |
| 標題(和) | 哺乳動物細胞内に存在するPAFアセチルハイドロラーゼの構造と機能に関する研究 | |
| 標題(洋) | ||
| 報告番号 | 212939 | |
| 報告番号 | 乙12939 | |
| 学位授与日 | 1996.07.10 | |
| 学位種別 | 論文博士 | |
| 学位種類 | 博士(薬学) | |
| 学位記番号 | 第12939号 | |
| 研究科 | ||
| 専攻 | ||
| 論文審査委員 | ||
| 内容要旨 | 血小板活性化因子(Platelet-activating factor、以下PAFと略す)は、その名のとおり血小板を強力に活性化する物質として発見されたリン脂質性のメディエイターであり、グリセロール骨格の1位にO-アルキル基、2位にアセチル基をもつ点が特徴である。PAFは主に炎症、免疫などの分野において研究されてきたが、特に最近になって、脳神経系においても様々な作用をもつことが発見され注目を集めている。しかし、脳神経細胞はPAF受容体をあまり発現していないと考えられることから、脳におけるPAFの作用点は不明である。PAFはnM以下の極微量な濃度で生物活性を発揮する一方で、高濃度になると強い細胞毒性をもつことから、生体内におけるPAFの濃度は厳密に制御されていると考えられる。しかし現在に至るまで、PAFの合成分解に関る酵素群について活性制御のレベルまで解明されたものはなく、PAFの生理作用を分子的に理解する上での障害となっている。これら酵素群の中でも、PAFのアセチル基を特異的に加水分解することでこれを不活化する酵素、PAFアセチルハイドロラーゼはPAF不活化の主役であり、PAF代謝に重要な役割を演じている。しかしこの酵素は発見から10年以上もの間、正確な分子量さえ不明であり、精製に成功したグループはなかった。私は、脳におけるPAFの生理的機能を知るためには、細胞内PAFアセチルハイドロラーゼの実体を明らかにすることが重要であると考えた。また、もしPAFアセチルハイドロラーゼの活性や存在量を分子生物学的手法によって変化させることができれば、PAFがリン脂質であるがための研究の困難さ(リアルタイムで濃度や局在性を知ることができない、外部から与える以外に人為的に濃度を調節することができない、など)を克服できる可能性があるとも考えた。そして、本学修士課程において、脳細胞質にはいくつかのPAFアセチルハイドロラーゼアイソフォームが存在することを見い出すとともに、そのうち最も主要な活性を担うアイソフォームIbの精製に世界ではじめて成功した。本酵素は、SDSポリアクリルアミドゲル電気泳動上での分子量が45kDa、30kDa、29kDaの三つのサブユニット(それぞれ  cDNAクローニングは、精製蛋白質から得た部分アミノ酸配列をもとにウシ脳cDNAライブラリーから行った。大腸菌における各サブユニットの発現にはpUC-pL-cI及びpET-21aベクターを用いた。COS7細胞における発現にはpRC/CMVベクターを用いた。活性セリン残基の同定には、トリチウム標識DFP(diisopropyl fluorophoaphate、活性セリン残基の特異的修飾剤)によって標識された残基を限定分解によって求める方法及び、site directed mutagenesisによるセリン残基からシステイン残基への変換によって行った。各サブユニット特異的抗体作製は、リコンビナント蛋白質を精製して免疫源とした。モノクローナル抗体産生細胞樹立は、免疫したマウスの脾臓細胞を、マウスミエローマ細胞PAIと細胞融合させることで行った。各サブユニットの生化学的解析やサブユニット間相互作用の検討は、クロスリンキング、カラムクロマトグラフィ、イムノブロッティング、DFPとの反応性の定量などを用いて行った。 ウシの細胞内PAFアセチルハイドロラーゼIbの  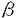 サブユニット サブユニット サブユニット(上段)の一次構造比較 サブユニット(上段)の一次構造比較 以上のように私は、世界で初めて細胞内PAFアセチルハイドロラーゼの精製及びcDNAクローニングに成功し、その構造解析を行った。本研究から考えられる本酵素の構造摸式図を図3に示した。今後はさらに本酵素の生理的機能を解明するために、各サブユニットの機能の同定、活性調節機構及びサブユニットアセンブリーの機構を調べることは不可欠である。さらに、細胞内においてPAFを結合することによって機能を調節される蛋白質(キナーゼや細胞骨格系蛋白質などが候補となると思う)や、PAFアセチルハイドロラーゼ各サブユニットと相互作用する蛋白質などを検索することで、未知のシグナル伝達経路が明らかになるかも知れない。特に、脳神経系の形成や高次機能にPAFがどのように関与しているかが今後の最大の課題であると考えられる。  | |
| 審査要旨 | PAF(platelet-activating factor)は様々の細胞が刺激に応答して産生され、標的細胞膜上の受容体を介して作用するメディエーターである。今日に到るまでその代謝に関る酵素の分子レベルにおける解明はなされてこなかった。本論文はPAFの分解に関る酵素の同定、単離、アミノ酸配列決定、高次構造解明、サブユニット欠損症の発見と機能推定よりなりたっている。 ウシ脳の10万g上清画分には3種以上のPAFアセチルハイドロラーゼ(PAF-AH)活性が検出された。そのうち活性も最も高い酵素をアイソフォームIbと命名し精製に成功した。 その結果PAF-AH Ibが PAF-AHアイソフォームIbは大脳、小脳、海馬などに主として局在し、海馬ではCA2、CA3領域などに分布するところから、神経細胞移動過程に関る可能性が考えられた。さらに本研究においてPAF-AHアイソフォームIbの 以上、本研究はPAF代謝に関る酵素を分子生物学手法によって構造的に明らかにしたもので、PAF分解酵素の機能、さらにはPAFそのものの機能の新しい側面を解明する糸口ともなるもので、生化学、神経科学の発展に寄与するところが大で、博士(薬学)の学位に価すると判明された。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/51011 |
 、
、