| I.目的・背景 リポソームの本格的な臨床応用のためには、リポソーム製剤に適した薬効・毒性の評価システムの構築ならびにリポソームの体内動態の把握が必要である。そこで、adriamycin(ADM)リポソーム製剤(L-ADM)を題材とし、その処方探索ならびに評価を通じて研究を行った。 II.製剤学的処方検討 リポソームとしては主薬保持率の高い処方が有利と考えられる。そこで、主薬保持率を高める手法として、カチオンであるADMとマイナスに荷電させたリポソームとの静電的吸着を利用することを試みた。リポソームにマイナス荷電を与える酸性脂質であるphosphatidylglycerol(以下PG)の比率を高めることにより、高い主薬保持率が得られた。リポソーム製剤化による体内動態制御効果をADMの毒性発現部位である心臓への移行性を指標に評価したところ、PGの比率が高く、したがって主薬保持率の高い処方で、心臓へのADMの移行性が抑制されており、静電的吸着を利用するというストラテジーの妥当性が確認された。こうした製剤学的評価および生物評価によるスクリーニングによって、L-ADMの3処方を選抜した。 Rp.47 eggPC/eggPG/cholesterol/ADM=6:4:10:1.3 Rp.49 eggPG/cholesterol/ADM=10:10:1.3 Rp.80 eggPC/DMPG/cholesterol/ADM=2:11.4:12:1.3(molar ratio) PGとして、dimyristoylphosphatidylglycerol(DMPG)を用いるRp.80は、中でも主薬保持率が高く、凍結乾燥の前後での粒子径変化を認めず、ラット血漿とのインキュベーション後も安定に主薬を保持でき、製剤物性に優れていた。Rp.80において、25リットルスケールまでの製造が可能であることを確認した。また安定性試験の結果、25℃以下の保存条件では、粒子径および主薬保持率に顕著な変化は認められず、ADMの化学的安定性のアレニウス解析より、凍結乾燥製剤として少なくとも冷蔵庫保存2年の安定性が保証できるものと考えられた。以下にこれらの処方の体内動態、抗腫瘍効果ならびに安全性研究の結果を示す。 III.体内動態検討 種々の制癌剤のリポソーム製剤の研究において、リポソーム製剤化による薬効及び毒性の制御効果を体内動態研究から予測し、評価する目的で実施される動態研究のほとんどは、単回投与試験で行われる。しかし、制癌剤の薬効や毒性は、単回投与ではなく、反復投与あるいは他剤との併用により、発現する場合が多いため、この点を考慮する必要がある。 マウス腫瘍MH-134皮下移植モデルの抗腫瘍試験のプロトコールに合わせ、腫瘍移植後、5日目および9日目に薬剤を投与し体内動態を検討した。L-ADM(Rp.47およびRp.49)の初回投与時と2回目投与時を比較し、特徴的な違いは、血漿および腫瘍において、2回目投与時の移行性が初回投与時に比べ、2倍以上も高くなっていること、ならびに2回目投与時の肝臓への移行性が、初回投与時に比べ、顕著に低下していることであった。リポソーム製剤の主なる分布組織である肝臓への移行性の低下が、血中濃度推移ならびに他の組織への分布の変化をもたらしているものと考えられる。実際、L-ADM(Rp.80)投与群では、投与後1日目から7日目まで、貪食活性はコントロールの1/3に低下していた[Fig.1]。これは、リポソームとともにADMが肝クッパー細胞など、細網内皮系の貪食細胞に集積し、これら細胞の機能を低下させた結果であると考えられる。この知見は、同じ反復投与でも、投与間隔の長短によって体内動態が全く異なることを示唆している。臨床では数週間の投与間隔で投与されると考えられるため、非臨床評価においても、細網内皮系の貪食活性が回復する程度の投与間隔での反復投与試験が望ましいと考えられる。  Fig.1 Systemic phagocytic activity after administration of F-ADM,L-ADM(Rp-80),or empty liposomes. Fig.1 Systemic phagocytic activity after administration of F-ADM,L-ADM(Rp-80),or empty liposomes. 次にADMの毒性発現部位である心臓への移行動態と血中における動態について検討を行った。検討には14C-ADMと3H-イヌリンで二重標識したL-ADM(Rp.80)を用いた。投与後初期には14C-ADMはリポソーム(3H-イヌリンの動態により評価)とともに心臓中に存在した。その後ADMは組織に留まるのに対し、イヌリンの心臓中濃度は、リポソームの血中消失とともに低下した。この結果から、L-ADM投与後ADMは、リポソームと遊離した形で心臓組織に移行することが示唆された。このことは、リポソームによるADMの動態の制御効果を把握する上で、血中におけるリポソームからのADMの遊離についての検討が重要であることを示している。そこで速度論モデルに基づき、リポソームからのADMの遊離速度をin vivoの実験から推定することを試みた。L-ADM投与後のADMの遊離クリアランスは、全身クリアランスの3分の1を占めていた。全身クリアランスは、リポソームの組織移行クリアランスと血中でのリポソームからの遊離クリアランスの和と考えられるが、この結果は、Rp.80からADMが、遊離しやすく、したがってリポソームの血中安定性を高めるべく、処方改良が必要であることを示している。実際には、Rp.80の処方改良・最適化研究は、実施しなかったが、こうした体内安定性の定量的評価は、リポソーム処方の最適化のための重要な情報を与えるものと言える。 次に、リポソームの調製方法の違いが、体内動態に及ぼす影響について、検討した。調製フロー中で薬物を添加するステップを変えた3つの方法、Method-1から3の速度論的な比較検討を行った。 Method-1:Lipid film作製時に薬物を添加する方法 Method-2:薬物を含まないLipid filmに薬物水溶液を加えて乳化する方法 Method-3:薬物を含まないリポソームの凍結乾燥製剤に薬物水溶液を加えて再構成する方法(凍結乾燥空リポソーム法) Method-1と比較し、Method-2および3では、ADMのかなりのフラクションが投与後にリポソームから遊離して挙動することが示唆された。このことから、Method-1では、ADMの多くが強い保持形態で保持されるのに対し、Method-2や3では、脂質膜が形成された後にADMを添加するため、強く保持されるサイトにアクセスできず、多くが容易に放出されるメカニズムでしかリポソームに保持されないのではないかと考えることができる。リポソームの臨床における実用化のためには、再現性の向上(即ち、製造ロット間の同等性保証のための因子の把握と制御が必要であるが、以上の結果は、組成や粒子径といった製剤物性と同様に製剤の調製法も重要な因子であることを示唆している。 IV抗腫瘍効果 マウス腫瘍Colon26皮下移植モデルにおいて、L-ADM(Rp.80)とADM水溶液(F-ADM)の同量投与群間での差は認められなかった。しかし、F-ADMでは、致死の毒性の発現する高投与量においてもL-ADMでは、体重減少などの毒性がほとんど発現せず、高投与量化が可能であり、これによって、強い治療効果が得られることが示された。 次に肝Kupffer細胞が薬物リザーバーとなって、徐放的に再放出されるADMが、薬効に寄与することを期待し、肝転移腫瘍モデルM5076担癌マウスを用い、抗腫瘍効果を検討した。同一用量7.5〜19.2mg/kgではF-ADM投与群に対し、L-ADM投与群は有意に優れた延命効果を示した[Fig.2]。一方、同じ肝転移モデルでも、L5178Y-MLマウスリンパ腫系では、F-ADMとL-ADMの延命効果に、有為な差は認められなかった[Table1]。これら2種の細胞を含めた6種の培養腫瘍細胞系において、L-ADMならびにF-ADMの取り込み挙動を検討した。L-ADM適用時には、主薬はリポソームに保持された状態で細胞に貪食されるよりは、むしろ主としてリポソームから遊離した後に腫瘍細胞内に取り込まれていることが示唆された[Fig.3]。検討した細胞の中では、M5076は貪食活性が高く、他の細胞に比べ、L-ADM適用時の主薬の移行性が比較的高かった[Fig.3]。L5178Y-MLのADMに対する感受性が低いため、リポソーム製剤化によって抗腫瘍効果が増強されても、それが検出できなかった可能性があるが、M5076肝転移モデルが、リポソーム製剤の移行性ならびに抗腫瘍効果を過大評価している可能性も否定できない。L-ADMの肝転移腫瘍への薬効を評価するためM5076肝転移モデルを用いた報告がなされているが、その妥当性については、更に検討が必要と言える。  Fig.2 Antitumor effect of F-ADM,L-ADM(Rp.80)and Epirubicin against liver metastasis model(M5076)in vivo.The figure in parenthesis reprents the number of survivors on day 40 from ten mice in each group.-〇- F-ADM -●- L-ADM(Rp.80) -△- Epirubicin Fig.2 Antitumor effect of F-ADM,L-ADM(Rp.80)and Epirubicin against liver metastasis model(M5076)in vivo.The figure in parenthesis reprents the number of survivors on day 40 from ten mice in each group.-〇- F-ADM -●- L-ADM(Rp.80) -△- Epirubicin Table 1 Effect of single administration of F-ADM or L-ADM on the survival of L5178Y-ML-bearing mice.§ Median survival time.§§ Increase in life span.¶ Lethal toxicity with severe body weight loss was observed.a)p<0.01 vs control b)p<0.05 vs control Table 1 Effect of single administration of F-ADM or L-ADM on the survival of L5178Y-ML-bearing mice.§ Median survival time.§§ Increase in life span.¶ Lethal toxicity with severe body weight loss was observed.a)p<0.01 vs control b)p<0.05 vs control Fig.3 Uptake of F-ADM and L-ADM by the cultured tumor cell lines in vitro at 37℃.Symbois;〇:[14C]-ADM from F-ADM;●:[14C]-ADM from L-ADM ;and▲:[3H]-inulin from L-ADM.V.毒性軽減効果 Fig.3 Uptake of F-ADM and L-ADM by the cultured tumor cell lines in vitro at 37℃.Symbois;〇:[14C]-ADM from F-ADM;●:[14C]-ADM from L-ADM ;and▲:[3H]-inulin from L-ADM.V.毒性軽減効果 制癌剤の臨床における使用時に問題となる血液毒性について検討した。ラットに単回投与した場合、L-ADM(Rp.49)では、F-ADMと比較し、明らかに血液毒性が軽減された[Fig.4a,b]。一方、中3日の短い間隔で2回投与した場合、血液毒性は軽減されず、白血球数に関しては回復の遅延が認められた[Fig.4c,d]。しかし、同じ2回投与でも投与間隔を中6日とながくした場合、リポソーム製剤として投与することにより、血液毒性は軽減され、回復遅延も認められなかった[Fig.4e,f]。L-ADMの血液毒性の投与スケジュール依存性の原因の1つとして、反復投与時の細網内皮系活性の抑制に伴う体内動態の変化を挙げることができる。L-ADMは、投与間隔が短い反復投与において、血液毒性が強くなるという傾向は、毒性学的見地からは、興味ある知見であるが、数週間の投与間隔での反復投与を行う臨床適用時の毒性を予測評価する上では、充分な評価とは言えない。 そこでラットを用い、1週間間歇4回投与により評価を行った。L-ADM(Rp.80)は、血液毒性が軽微であり、回復性も良好であった[Fig.5]。臨床症状ならびに心毒性[Fig.6]もリポソーム製剤とすることにより抑制されることが示された。 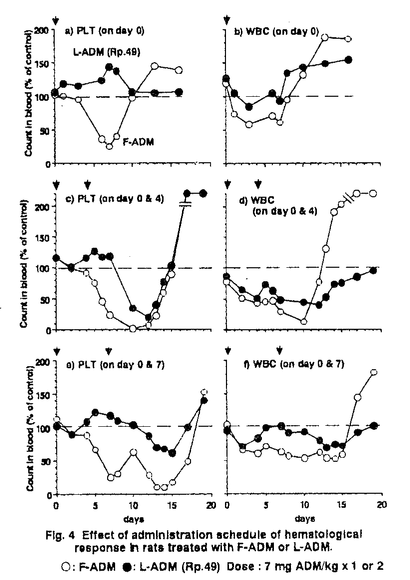 Fig.4 Effect of administration schedule of hematological response in rats treated with F-ADM or L-ADM.〇:F-ADM ●:L-ADM(Rp.49)Dose:7mg ADM/kg×1or2 Fig.4 Effect of administration schedule of hematological response in rats treated with F-ADM or L-ADM.〇:F-ADM ●:L-ADM(Rp.49)Dose:7mg ADM/kg×1or2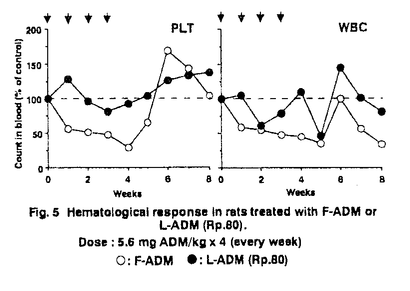 Fig.5 Hematological response in rats treated with F-ADM or L-ADM(Rp.80).Dose:5.6mg ADM/kg×4(every week)〇:F-ADM ●:L-ADM(Rp.80) Fig.5 Hematological response in rats treated with F-ADM or L-ADM(Rp.80).Dose:5.6mg ADM/kg×4(every week)〇:F-ADM ●:L-ADM(Rp.80) Fig.6 Cardlotoxicity assessed by electrocardlography in rats treated with F-ADM or L-ADM(Rp.80).Administration:every week(on days0,7,14 and 21)low dose:2.8mg ADM/kg×4 high dose:5.6mg ADM/kg×4VI.総括 Fig.6 Cardlotoxicity assessed by electrocardlography in rats treated with F-ADM or L-ADM(Rp.80).Administration:every week(on days0,7,14 and 21)low dose:2.8mg ADM/kg×4 high dose:5.6mg ADM/kg×4VI.総括 主薬保持率を指標とした製剤学的処方検討により、酸性リン脂質であるPGを構成成分とする製剤処方Rp.47、49ならびに80を見出した。PGとしてDMPGを用いるRp.80は、製剤物性に優れており、これについては、25リットルスケールまでの製造ならびに安定性保証が可能であることを確認した。 L-ADM投与後、ADMは、心臓組織や腫瘍細胞へは、主にリポソームから遊離した後に移行することが示唆された。 Rp.80では、ADMに比べ、高い主薬理効果が得られ、毒性が軽減されることが、in vivo試験により確認された。体内動態ならびに血液毒性に関して、短い投与間隔での反復投与時に大きくその傾向が変化するという知見が得られ、L-ADMの評価には、臨床での用法やこのようなリポソームの特性を充分に考慮し、反復投与試験の場合には、投与間隔を少なくとも1週間以上とする必要があると考えられた。 薬物の薬効や物性によって最適なリポソームの処方は異なると考えられるが、演繹的に最適処方を設計し、適切な評価を行うため、以上の研究の成果は、少なからず貢献するものと考える。 |