癌に伴う高Ca血症・cachexiaは患者のQOLを大きく左右し予後を決定する重要な合併症である。前者の主要な惹起因子としてparathyroid hormone-related peptide(PTHRP)が同定され、またcachexiaに関してはTumor Necrosis Factor(TNF-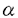 )、Interleukin-6(IL-6)、Leukemia Inhibitory Factor(LIF)などが候補因子として考えられている。 )、Interleukin-6(IL-6)、Leukemia Inhibitory Factor(LIF)などが候補因子として考えられている。 本研究では、活性型ビタミンDである1,25(OH)2D3のアナログで副作用が少なく比較的大量を安全に投与できるように開発された22-oxa-1,25(OH)2D3(OCT)の(1)PTHRP遺伝子の転写に対する効果、(2)高Ca血症・cachexiaに対するin vivoでの治療効果および(3)薬物動態上の特性について検討し、下記の結果を得ている。 1、PTHRP mRNAを過剰に発現するヒト膵癌株(FA-6)を移植したヌードマウスを用いて、OCTのPTHRP mRNA発現に対する効果を検討した。OCTは4週間週5回の経口投与においても、週2-3回の静脈内投与においても、腫瘍内のPTHRP mRNAレベルを著明に抑制することが示された。 2、OCTは0.0625から6.25 g/kgまで用量依存的にPTHRP mRNAの発現を抑制した。また、時間経過に関しては、投与後1日目には3匹中2匹に於いてPTHRP mRNAレベルの低下が観察され、4日目には3匹中すべての腫瘍でPTHRP mRNAが明らかに減少することが示された。 g/kgまで用量依存的にPTHRP mRNAの発現を抑制した。また、時間経過に関しては、投与後1日目には3匹中2匹に於いてPTHRP mRNAレベルの低下が観察され、4日目には3匹中すべての腫瘍でPTHRP mRNAが明らかに減少することが示された。 3、VehicleあるいはOCTを投与した担癌動物のFA-6腫瘍より核を抽出し、in vitroでPTHRP遺伝子の転写速度を測定した。Nuclear run-off assayの結果、OCTはactin遺伝子の転写には影響を与えずPTHRP遺伝子の転写速度を減少させ、OCTが転写レベルでPTHRP mRNAの発現を抑制することが明らかとなった。 4、ヒトPTHRP遺伝子の3つのプロモーターのうちどれがFA-6において働いているか、またそのいずれがOCTによる転写の抑制効果を受けるかを決定するために、antisense RNAプローブを作成しRNase mappingを行なった。その結果、この腫瘍では下流のプロモーターも上流のプロモーターもほぼ同程度に使われていること、さらにOCTの投与によりこれら両方のバンドが減少したことから、OCTが上流および下流プロモーターの両方からの転写を抑制することが示唆された。 5、OCTがFA-6腫瘍におけるPTHRP遺伝子の転写を強力に抑制するという以上の成績に基づいて、OCTの全身投与が実際に、癌に伴う高Ca血症に対して予防効果あるいは治療効果を発揮するか否かを検討した。予防効果に関しては、担癌動物の血中Ca2+がわずかに上昇する移植後12日目からOCTの投与を開始したところ、vehicle投与群では癌の進展に伴って血中Ca2+が著明に上昇したのに対して、OCT投与群では、経口投与でもあるいは静脈内投与でも高Ca血症の進展を著明に抑制した。次に、すでに著明な高Ca血症を呈する担癌ヌードマウスに対するOCTの治療効果について検討した。移植後24日目で、血中Ca2+が著しく上昇した時点からOCTを週2-3回の割合で4週間静脈内投与したところ、vehicle投与群ではさらに血中Ca2+が上昇したのに対して、OCT投与群は血中Ca2+の有意な低下が認められた。 6、実験で用いた担癌モデルは癌の進展に伴って著明なcachexiaを呈したので、このcachexiaに対するOCTの効果についても検討した。移植後24日目で著しく血中Ca2+が上昇した状態では、age-matchedの非担癌ヌードマウスの23-24gに対して、FA-6腫瘍を移植した動物はすでに20-21gと体重減少を示した。Vehicle投与群では、実験期間の4週間でさらに16gまで体重が減少したのに対して、OCTを週2-3回の割合で4週間静脈内投与した群では体重減少が著明に抑制することが明らかとなった。 7、以上の結果として、OCTが担癌動物に対して延命効果を発揮するか否かを検討した。Vehicle投与群では3ヶ月以内にすべて死亡したのに対して、OCTを3週間だけ投与した群では最高6カ月以上生存し、平均すると約1.5倍の延命効果が認められた。 8、1,25(OH)2D3は強力な高Ca血症作用を有するのに対して、OCTそれ自体はかなり高用量投与してもほとんど高Ca血症をきたさない。そこでこの作用の違いを明らかにするために、OCTの薬物動態を1,25(OH)2D3と比較検討した。FA-6腫瘍を移植したヌードマウスにOCTと1,25(OH)2D3のラベル体を経静脈的に投与し、それぞれの化合物の組織分布を10、60、180分後に測定した。その結果、[3H]OCTは[3H]1,25(OH)2D3よりも速やかに血中より消失するとともに、肝臓でも速やかに代謝されることが明らかとなった。また小腸や腎臓などビタミンDの古典的な標的臓器においても、腫瘍組織においても、1,25(OH)2D3の取り込みが3時間以上上昇し続けたのに対してOCTの取り込みは一過性で1時間でピークを示した。以上の成績から、薬物動態上の違いがOCTそれ自体に極めて高Ca血症が少ない事実を説明しうると結論した。 以上のように、本論文は(1)ビタミンDアナログ(OCT)が癌組織に効率的に取り込まれ、(2)PTHRP遺伝子の転写を強力に抑制することにより癌に伴う高Ca血症に対して治療効果を発揮すること、(3)OCTの薬物動態上の特性が幅広い治療域を有する安全な治療薬として投与できる大きな根拠となっていることを証明した。 本研究は、癌に伴う高Ca血症・cachexiaなどの治療薬としてのOCTのポテンシャルを見いだしかつその作用メカニズムの解明に対して重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |