ビタミンDは活性型のホルモンとして標的組織においてその作用を発揮する前に体内において2段階の修飾を受けることが知られている。皮膚で紫外線により合成された、又は食物より摂取されたビタミンDは、肝臓に運ばれまず25位が水酸化を受ける。この水酸化はあまり厳密にコントロールされておらず、生成した25-hydroxyvitamin D3[25(OH)D3の血中濃度は主にビタミンDの供給状態を反映すると言ってよい。その後、この25(OH)D3は腎臓に運ばれ、主に腎臓の近位尿細管において1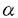 位、又は24位が水酸化を受けることにより、活性型の1,25-dihydroxyvitamin D3[1,25(OH)2D3]に又はやや不活性型の24.25-dihydroxyvitamin D3[24,25(OH)2D3]へと変換される。この腎臓における25(OH)D3の2つの水酸化は厳密にそして逆方向にコントロールされており(代謝スイッチ)、それにより体内のビタミンD内分泌系の活性が調節されていることが知られている。 位、又は24位が水酸化を受けることにより、活性型の1,25-dihydroxyvitamin D3[1,25(OH)2D3]に又はやや不活性型の24.25-dihydroxyvitamin D3[24,25(OH)2D3]へと変換される。この腎臓における25(OH)D3の2つの水酸化は厳密にそして逆方向にコントロールされており(代謝スイッチ)、それにより体内のビタミンD内分泌系の活性が調節されていることが知られている。 このように腎臓は体内の1,25(OH)2D3の主要な内分泌臓器であるが、同時にビタミンD受容体(VDR)を発現する標的臓器としても知られている。そこでまず腎臓でのビタミンDの代謝および作用の部位を探る目的で、microdissectionにより正常ラットの尿細管の各セグメントを分離採取し、mRNAを抽出後RT-PCR法を用いて24水酸化酵素(24-OHase)及びVDRのmRNAの発現を調べた。その結果、24-OHase mRNAは近位尿細管に集中してその発現が認められるのに対し、VDR mRNAは近位尿細管を含めほぼ普遍的にその発現を認めた。前述したように近位尿細管は体内の1,25(OH)2D3の主要な産生組織であるが、同時にそのレセプターを発現する標的組織でもあることになる。しかしながら1,25(OH)2D3は25(OH)D3を活性化する1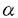 水酸化酵素(1 水酸化酵素(1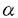 -OHase)を抑制し、不活性化する24-OHaseを誘導することが知られており、これにより矛盾が生じることになる(図1)。つまり近位尿細管での1,25(OH)2D3の産生が亢進した状態で、その細胞にVDRが存在すると24-OHaseは誘導され、1 -OHase)を抑制し、不活性化する24-OHaseを誘導することが知られており、これにより矛盾が生じることになる(図1)。つまり近位尿細管での1,25(OH)2D3の産生が亢進した状態で、その細胞にVDRが存在すると24-OHaseは誘導され、1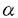 -OHaseは抑制されるはずである。しかし実際は近位尿細管での1,25(OH)2D3の産生が亢進した状態では24-OHaseは抑制され、1 -OHaseは抑制されるはずである。しかし実際は近位尿細管での1,25(OH)2D3の産生が亢進した状態では24-OHaseは抑制され、1 -OHaseは誘導されているわけで、このメカニズムから予想される結果は現実とは逆になってしまう。 -OHaseは誘導されているわけで、このメカニズムから予想される結果は現実とは逆になってしまう。 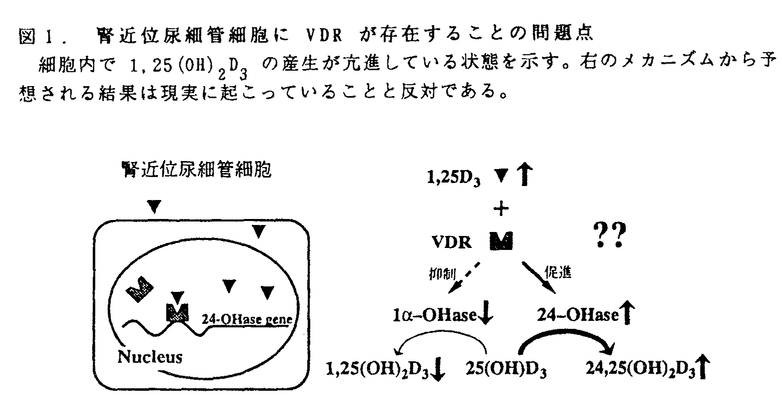 図1.腎近位尿細管細胞にVDRが存在することの問題点細胞内で1,25(OH)2D3の産生が亢進している状態を示す。右のメカニズムから予想される結果は現実に起こっていることと反対である。 図1.腎近位尿細管細胞にVDRが存在することの問題点細胞内で1,25(OH)2D3の産生が亢進している状態を示す。右のメカニズムから予想される結果は現実に起こっていることと反対である。 この問題を説明するため、我々は近位尿細管での1,25(OH)2D3の産生が亢進しているときはVDRはなくなっているのではないかと考えた。またこのような近位尿細管でのVDRの発現量の調節が、ビタミンDの代謝スイッチを可能にすることに気付いた(図2)。 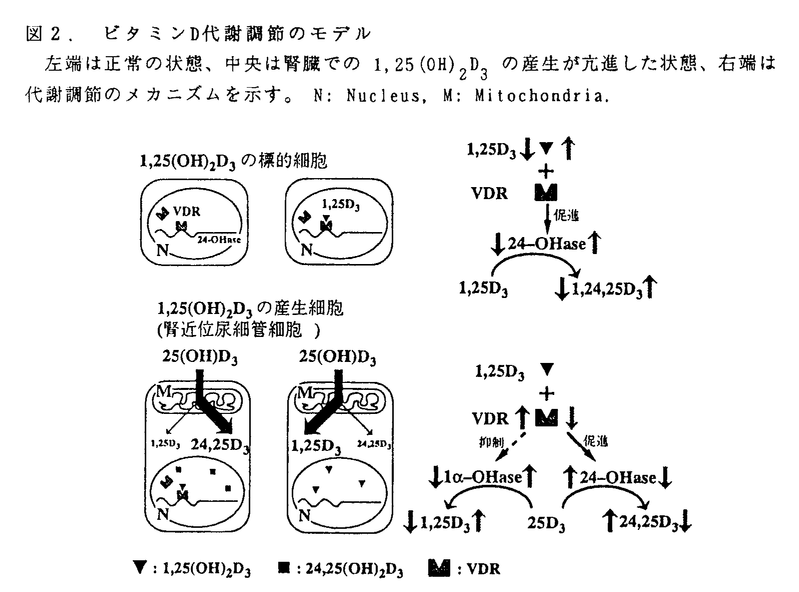 図2.ビタミンD代謝調節のモデル左端は正常の状態、中央は腎臓での1,25(OH)2D3の産生が亢進した状態、右端は代謝調節のメカニズムを示す。N:Nucleus,M:Mitochondria. 図2.ビタミンD代謝調節のモデル左端は正常の状態、中央は腎臓での1,25(OH)2D3の産生が亢進した状態、右端は代謝調節のメカニズムを示す。N:Nucleus,M:Mitochondria. そこでモデル動物を用いてこの仮説の妥当性について検討することにした。動物は3週齢のSDラットを用い、ビタミンDを含む、正常食、Ca欠乏食、P欠乏食にて飼育した後、実験に供した。1,25(OH)2D3の内分泌組織としては近位曲尿細管(PCT)を、また1,25(OH)2D3の標的組織としては皮質部集合管(CCD)及び十二指腸を用いた。腎臓はmicrodissection RT-PCR法により、十二指腸はmRNAを抽出後Northern blot法によりVDRならびに24-OHaseのmRNAの発現を検討した。 その結果、PCTにおけるVDR及び24-OHase mRNAの発現は腎臓での1,25(OH)2D3の産生が亢進したモデル(Ca欠乏食群、P欠乏食群)では著明に抑制され、逆に腎臓での24,25(OH)2D3の産生が亢進したモデル(正常食群)ではその発現が充分に認められることを明らかにした。尚、CCD及び十二指腸でのVDR mRNAの発現は各群間で顕著な変化はなかった。十二指腸での24-OHase mRNAの発現は腎での1,25(OH)2D3の産生が亢進したモデル(Ca欠乏食群、P欠乏食群)において著明に誘導されていた。またCCDにおいてもCa欠乏食群において24-OHase mRNAの誘導がみられたが、正常食群のPCTと比べかなり低レベルであった。前述の如く、正常ラットにおいては、24-OHase mRNAはほぼ近位尿細管に集中してその発現を認めるが、これは近位尿細管が1,25(OH)2D3の主要な内分泌組織であり、自身の作り出した1,25(OH)2D3によりおそらくはautocrine/paracrineのような強力なメカニズムにより同部位において24-OHase mRNAが誘導されるためと考えられる。 更にビタミンDを含まないCa欠乏食で飼育したラットにおいても、PCTにおけるVDR mRNAの著明な減少を認め、Ca欠乏食飼育によるPCTでのVDR mRNAの減少が1,25(OH)2D3産生亢進の結果ではないことが示された。 尚、成長した雄のうずらにsex steroidを作用させると腎臓でのビタミンDの代謝スイッチがおこることが知られており、このモデルにおいても腎臓及び十二指腸よりmRNAを抽出後Northern blot法によりVDR mRNAの発現を調べた。その結果、Estradiol又はEstradiol+Testosteroneの皮下投与により腎臓の1 -OHaseの活性が亢進した状態において、VDR mRNAの発現は腎臓では抑制されているが、十二指腸では殆ど変化がないことを明らかにした。 -OHaseの活性が亢進した状態において、VDR mRNAの発現は腎臓では抑制されているが、十二指腸では殆ど変化がないことを明らかにした。 これらは全てVDRの量をmRNAレベルで測定している点、そしてPCTにおけるVDR mRNAの減少が1,25(OH)2D3産生亢進の原因であることを直接的に示すものではない点等、若干の不備は残るが、今回の結果を最も合理的に説明できるのは図2のモデルであると考えた。つまり腎臓の近位尿細管においては、ビタミンDのレセプターの量が、そのリガンドであるビタミンDの活性化及び不活性化を調節していると結論した。しかし、この近位尿細管におけるVDR mRNAの発現調節の機序は未だ不明である。 尚、VDR遺伝子の突然変異により、遺伝性低Ca血症性ビタミンD抵抗性クル病が発症することが知られているが、この病気の患者の血清1,25(OH)2D3レベルは高値を示す。今回の結果より考えると、変異により不安定で機能不全に陥ったVDRは、標的組織での1,25(OH)2D3の代謝を減少させるのみならず、腎臓での1,25(OH)2D3の産生を亢進させるため、血清の1,25(OH)2D3レベルが上昇すると考えられる。 |