| 1.研究の背景と目的 アポ蛋白Eは分子量33,000の糖蛋白で、リポ蛋白上に広く存在し、またLDL受容体、レムナント受容体への結合能を有し、カイロミクロンレムナント、IDL、HDLcなどのコレステロールに富むリポ蛋白の処理に重要な役割を果たしている。また、アポ蛋白Eは神経組織、副腎、性腺、マクロファージなどのリポ蛋白非分泌組織においても合成され、細胞のコレステロール代謝に深く関与していると考えられている。 モルモットを始めとする数種の動物において、食事性のコレステロール負荷に対してアポ蛋白Eの血清濃度の増加が見られ、主たる合成臓器である肝臓において、コレステロール負荷に対する処理のために合目的的な合成分泌の亢進反応が起きていると考えられる。また、モルモットは、LDLを主なコレステロール担体とする点でもヒトとよく似たコレステロール代謝を有していると考えられる。 本研究ではコレステロール負荷に対するアポ蛋白Eの合成調節を解析する目的で、モデル動物としてモルモットを用い、アポ蛋白EcDNA、およびゲノムDNAのクローニングを行い、これを用いてアポ蛋白Eアミノ酸配列の解析と特異な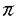 螺旋構造の存在の検証、コレステロール負荷に対する肝でのアポ蛋白E合成亢進のmRNAでの解析、コレステロール負荷に対するアポ蛋白EDNA転写昂進に関連した肝核蛋白の解析を行った。 螺旋構造の存在の検証、コレステロール負荷に対する肝でのアポ蛋白E合成亢進のmRNAでの解析、コレステロール負荷に対するアポ蛋白EDNA転写昂進に関連した肝核蛋白の解析を行った。 2.モルモットアポ蛋白EcDNAのクローニングとペプチド構造の解析 モルモット肝よりGuSCN法によりRNAを抽出、mRNAを精製して、pUCベクターに挿入し、標識したラットアポ蛋白EcDNAをプローブとしてモルモットアポ蛋白EcDNAをクローニングした。 モルモットアポ蛋白EcDNAは1144塩基、これより推定されたアミノ酸配列は280アミノ酸残基からなり、ヒトアポ蛋白Eに対しDNAレベルで77.7%、アミノ酸レベルで68.5%の相同性を有していた。モルモットアミノ酸配列の内、N末端寄りの第14から54残基に相当する領域は多くの種を通じて高度に保存されていたが、その1次構造からは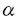 螺旋、 螺旋、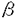 構造が推定されず、これまで自然界の蛋白には存在が認められていなかった2次構造である 構造が推定されず、これまで自然界の蛋白には存在が認められていなかった2次構造である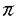 螺旋構造を形成する可能性が考えられた。この領域が 螺旋構造を形成する可能性が考えられた。この領域が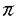 螺旋構造をとった場合、強い両親媒性を呈することが推定されたので、この領域の合成ペプチドを作成して検討したところ、ペプチドは水空気界面における等温曲線で強い被圧縮性を示し、両親媒性に基づく単分子膜を形成していることが示された。また、この合成ペプチドのCDスペクトルは、 螺旋構造をとった場合、強い両親媒性を呈することが推定されたので、この領域の合成ペプチドを作成して検討したところ、ペプチドは水空気界面における等温曲線で強い被圧縮性を示し、両親媒性に基づく単分子膜を形成していることが示された。また、この合成ペプチドのCDスペクトルは、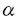 螺旋とは異なる204nmと217.5nmに極小を有し、またリポゾームの添加によりこれが強調された。 螺旋とは異なる204nmと217.5nmに極小を有し、またリポゾームの添加によりこれが強調された。 これらのことより、この領域は両親媒性を有し、かつ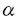 螺旋とは異なる螺旋構造、すなわち 螺旋とは異なる螺旋構造、すなわち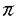 螺旋を形成している可能性が示された。 螺旋を形成している可能性が示された。 3.コレステロール負荷に対するモルモットアポ蛋白EmRNAの反応 モルモットを普通飼料、または5%トウモロコシ油または椰子油を含む1%コレステロール負荷飼料で4〜12週間飼育し、血清脂質、アポ蛋白の定量、およびNorthern blot法による肝アポ蛋白EmRNAの定量を行った。 コレステロール負荷動物では、著明な高コレステロール血症の発症と共に、肝アポ蛋白EmRNAの増加が見られ、この増加はトウモロコシ油と同時にコレステロールを負荷した群に著明であり、多価不飽和脂肪酸のアポ蛋白E増加作用を通じた高脂血症抑制の作用が示唆された。 正常動物、およびコレステロール負荷動物の肝からコラゲナーゼ潅流法により肝細胞を分離し、通常培地、またはリポ蛋白負荷した培地中を用いて初代培養を行い、アポ蛋白EmRNAの変化を観察した。個体または培地中へのコレステロール負荷により、肝細胞初代培養系においてもアポ蛋白EmRNAの増加が認められた。一方、肝のコレステロールプール減少の効果を観察する目的で、肝でのコレステロール合成抑制が知られるHMGCoA還元酵素阻害剤を高コレステロール食と共にモルモットに投与した。薬剤投与群では、コレステロール負荷食により惹起される高コレステロール血症は低減し、肝のアポ蛋白EmRNAの増加も低下した。 肝へのコレステロール負荷、または負荷の減少が、肝でのアポ蛋白EmRNA合成のそれぞれ亢進と抑制を惹き起こすることが認められた。 4.モルモットアポ蛋白E遺伝子DNAのクローニングと転写因子の解析 肝細胞内コレステロールの増加に対するアポ蛋白EDNA転写の亢進の機序を解明する目的で、アポ蛋白EDNAと肝核蛋白の結合を観察し、転写調節因子を解析した。モルモットアポ蛋白EゲノムDNAをクローニングし、5’上流制御領域-11〜-197を32Pで標識した。普通飼料またはコレステロール負荷飼料で飼育したモルモットの肝をホモゲナイズし、庶糖密度勾配超遠心で核を精製し、核蛋白を調製した。標識アポ蛋白EDNAと肝核蛋白を特異的、または非特異的キャリアーと共に孵置し、電気泳動し、DNA-核蛋白の結合を観察した(ゲルシフト解析)。標識アポ蛋白EDNAを肝核蛋白の存在下でDNAseIで酵素消化したのち電気泳動し、蛋白による保護を観察した(DNAseIフットプリント解析)。電気泳動した肝核蛋白をナイロン膜に転写し、標識アポ蛋白EDNAでブロッティングを行い、オートラディオグラフィーで観察した(サウスウェスタンブロット解析)。 3982塩基対のアポ蛋白EゲノムDNAがクローン化され、アポ蛋白EDNAは3154塩基対からなる4エクソン構造を有していた。アポ蛋白EDNAの5’上流領域はHarr plot解析によりヒトDNAに対して高い相同性をもつことが認められた。5’上流領域の2次構造の解析において、これまで知られているGC box、SRE類似領域の他に多くのヘアピン構造の存在が推定された。 ゲルシフト解析において、アポ蛋白EDNAに特異的に結合する核蛋白の存在が認められた。核蛋白試料としてコレステロール負荷動物からの肝核蛋白抽出液を反応に用いると、ゲルシフトパターンに変化がみられ、コレステロール負荷により新たに出現する結合、および増強する結合、消失する結合がみられた。DNAseIフットプリント解析において、核蛋白との結合によって保護されたいくつかの領域が観察され、GCbox、SRE類似領域より上流域にも認められた。コレステロール負荷動物からの肝核蛋白をアポ蛋白EDNAプローブと孵置すると、酵素反応から保護されずに新たに出現する消化断片が認められた。サウスウェスタンプロット解析において、33kDaと110kDaの位置にシグナルが認められた。コレステロール負荷動物からの肝核蛋白を用いると33kDaのシグナルはほとんど認められなかった。 3つの実験の結果から、肝核蛋白中にはアポ蛋白EDNAの数カ所に特異的に結合する数種の蛋白が存在し、コレステロール負荷時に核蛋白とDNAの結合が消失、または減弱する現象が共通して認められた。33kDaの蛋白がコレステロール負荷によるアポ蛋白E転写亢進に関連した転写因子である可能性が示唆された。 5.まとめ アポ蛋白Eは受容体結合能を介してコレステロールに富むリポ蛋白の代謝を促進し、その合成調節は高コレステロール血症、動脈硬化の治療に結びつくと考えられる。本研究では、アポ蛋白Eに脂質結合能を有する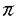 螺旋領域が存在しうること、コレステロール負荷に対して肝でのアポ蛋白Eの合成がmRNAレベルで亢進していること、コレステロール負荷時のアポ蛋白EDNA転写亢進に関連した調節因子と考えられる肝核蛋白が存在することを観察した。 螺旋領域が存在しうること、コレステロール負荷に対して肝でのアポ蛋白Eの合成がmRNAレベルで亢進していること、コレステロール負荷時のアポ蛋白EDNA転写亢進に関連した調節因子と考えられる肝核蛋白が存在することを観察した。 |