今日の医療の目覚ましい進歩は、難病患者の生命を長らえた反面、易感染性宿主を増加させる結果となり、人口の老齢化と相まって、日和見感染型の深在性真菌症が近年顕著な増加傾向を示している。このように真菌症が医療現場で大きな問題になってきている反面、投与される抗真菌剤の研究、開発は、その種類・効果共に大きな進展は見られず、満足できるものではない。このような現状分析のもと、我々は新しい抗真菌薬の発見、開発を目的として研究を行った。まず、i)抗真菌剤の標的分子を文献上の情報を元に、sulfate assimilation pathwayを選択し、動物実験によって化学療法上の標的になる事を確認した。ii)微生物培養液のスクリーニングを行ってその阻害剤を探索し、新規抗真菌物質、azoxybacilin、を得た。iii)作用機作を精査し、sulfate assimilation pathwayの酵素の一つ、sulfite reductaseの活性誘導を阻害する事を示した。iv)またその阻害機構の少なくとも一部は、転写活性化因子Met4p、Cbf1pを介する転写抑制によって引き起こされるという新しい作用機作を持つ事を示した。さらに、v)azoxybacilinの細胞内取り込みルートを調べ、この知見から化学修飾によって動物実験において抗真菌活性のある化合物を得た。 我々は、次に示す3つの評価項目を評価基準として、まず抗真菌剤targetの選定を行った;i)哺乳類と真菌の間の選択毒性、ii)真菌にとっての必須性、iii)重要な病原真菌内の分布。蛋白分子あるいは経路を系統的に調べ、含硫アミノ酸生合成経路の上流に位置するsulfate assimilation pathway(図表1)を選んだ。この経路は、哺乳類には全く存在せず、真菌には普遍的に存在する。最も重要な病原真菌の一つCandida albicansのmethionine要求株を用いてマウスに対する病原性を調べたところ、野性株に比較して、顕著にその病原性が低下し、sulfate assimilation pathwayが、抗真菌剤のtargetとして活用できる事が示された。 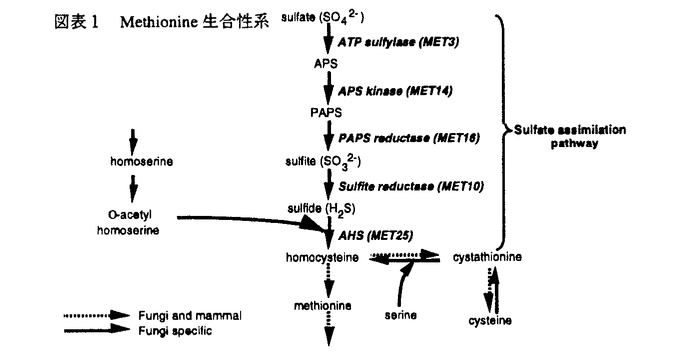 図表1 Methionine生合性系 図表1 Methionine生合性系 次に、sulfate assimilation pathwayの選択的阻害剤のスクリーニングを行った。Sulfate assimilation pathway欠損株は、完全合成最少培地では生育しないが、methionine添加培地では生育できるという性質を利用し、methionine添加によってその活性が拮抗される抗真菌物質を、微生物培養液をscreening sourceとして探索した。その結果、Bacillus cereusの培養上清より、図表2に示す新規抗真菌物質、azoxybacilin、を得た。この物質は、医学上重要な真菌に対してin vitroにおいて広い抗真菌スペクトラムを示し、既存の抗真菌剤の耐性株に対して交差耐性を示さなかった。 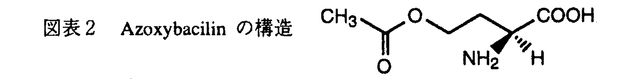 図表2 Azoxybacilinの構造 図表2 Azoxybacilinの構造 Azoxybacilinの作用機作を調べるため、まず、20種類のアミノ酸を別々に添加して azoxybacilinの抗真菌活性を調べたところ、methionine及びcysteineによってのみ拮抗が見られた。Methionine、cysteine生合成系の中間体を用いた添加実験では、homocysteine、cysteine、cystathionine、methionineが拮抗し、これは、O-acetyl-homoserine sulfhydrylase(AHS、sulfate assimilation pathway最終段階の酵素)の欠損株を生育させるアミノ酸と完全に一致した。さらに、azoxybacilinは、DNA、RNA、蛋白合成に影響を与えない濃度で、ラベルされたSO4の細胞内酸不溶性分画への取り込みを有意に低下させた。これらの実験結果は、azoxybacilinのprimary targetが、sulfate assimilation pathwayである事を示している。 Azoxybacilinがsulfate assimilation pathwayのどこを阻害しているかを検討するために、まず、本経路を構成する5つの酵素活性(ATP sulflylase,APS kinase,PAPS reductase,Sulfite reductase,AHS)の阻害効果をin vitroで調べたが、azoxybacilinはどの酵素に対しても直接的な阻害活性を示さなかった。Saccharomycescerevisiaeにおいて、sulfate assimilation pathwayの各酵素活性は、培地中のmethionineを除いた場合にその活性が強く誘導される事が報告されている。また、Echerichia coliにおいても、同様にcysteine starvationにより活性化が引き起こされるが、その際に起こる転写活性化には、cysteine生合成中間体であるO-acetylserineが直接かかわっている事が、in vitroの転写開始実験で明らかにされている。そこで、azoxybacilinがこの調節機構に関与している可能性があると考え、各酵素の活性化に対するazoxybacilinの影響を調べた。検討した3種類の酵素(ATP sulfurylase,Sulfite reductase,AHS)は共に、その活性化をazoxybacilinが阻害した。特にsulfite reductaseに対する阻害効果は強く(図表3)(IC50=3.2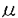 g/ml)、抗真菌活性(IC50=2.5 g/ml)、抗真菌活性(IC50=2.5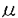 g/ml)、及びSO4の取り込み阻害活性(IC50=3.6 g/ml)、及びSO4の取り込み阻害活性(IC50=3.6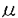 g/ml)と、その阻害程度がほぼ一致していた。これらの実験結果は、azoxybacilinの抗真菌活性が、sulfite reductase活性の誘導阻害によって引き起こされる事を示唆する。 g/ml)と、その阻害程度がほぼ一致していた。これらの実験結果は、azoxybacilinの抗真菌活性が、sulfite reductase活性の誘導阻害によって引き起こされる事を示唆する。 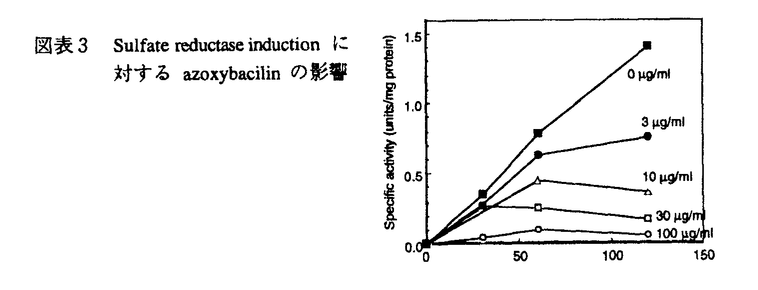 図表3 Sulfate reductase inductionに対するazoxybacilinの影響 図表3 Sulfate reductase inductionに対するazoxybacilinの影響 Azoxybacilinによるsulfite reductase活性誘導が、転写レベルで起こっているかどうかを調べるために、MET10 gene(この研究によりcloningされた)をプローブにし、northern解析を行った。その結果、azoxybacilinはMET10のmRNAレベルを濃度依存的に阻害した。他のsulfate assimilation pathway酵素の構造遺伝子(MET3、MET14、MET16、MET25)のnorthern解析も同時に行ったところ、程度の差はあるものの、どの遺伝子もazoxybacilinによって負の影響を受ける事が分かった。MET3、MET14、MET16、MET25の転写には、転写活性化因子であるMET4遺伝子産物(Met4p)が必要である事が、既に報告されていたので、次にこのMET4遺伝子の転写についてreporter遺伝子 (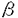 -galactosidase=LacZ)との融合遺伝子を構築して調べた。これらをS.cerevisiae野性株及びmet4欠損株にintegrateした後に、LacZ活性を測定した結果、Met4pに依存し、azoxybacilinによって阻害されるUAS(upstream activating sequence)が見いだされた。Met4pによって転写が活性化されるという報告のある他の遺伝子、MET3、MET14及び新規遺伝子MET10についても、プロモーター解析を行い、azoxybacilinに対する影響を調べたところ、どのプロモーターにおいても、Met4p依存性でazoxybacilinによって阻害を受けるUASの存在が示され、これらUASの塩基配列には、転写活性化因子CbfIpの結合配列(CDEI)のみが共通配列として見い出された。次に、MET4プロモーターUAS1をプローブとしたgel-retardation assayを行い、結合蛋白質について検討した。E.coliで発現したrecombinant CbfIpはUAS1に結合し、azoxybailinはこの結合活性には影響を与えなかったが、S.cerevisiaeの粗抽出画分を用いた実験では、control細胞では結合活性が認められたのに対し、azoxybacilin処理細胞から調整した粗抽出画分ではその結合活性が減少していた。また、azoxybacilin処理によってCbfIpの蛋白量は変化しなかった。 -galactosidase=LacZ)との融合遺伝子を構築して調べた。これらをS.cerevisiae野性株及びmet4欠損株にintegrateした後に、LacZ活性を測定した結果、Met4pに依存し、azoxybacilinによって阻害されるUAS(upstream activating sequence)が見いだされた。Met4pによって転写が活性化されるという報告のある他の遺伝子、MET3、MET14及び新規遺伝子MET10についても、プロモーター解析を行い、azoxybacilinに対する影響を調べたところ、どのプロモーターにおいても、Met4p依存性でazoxybacilinによって阻害を受けるUASの存在が示され、これらUASの塩基配列には、転写活性化因子CbfIpの結合配列(CDEI)のみが共通配列として見い出された。次に、MET4プロモーターUAS1をプローブとしたgel-retardation assayを行い、結合蛋白質について検討した。E.coliで発現したrecombinant CbfIpはUAS1に結合し、azoxybailinはこの結合活性には影響を与えなかったが、S.cerevisiaeの粗抽出画分を用いた実験では、control細胞では結合活性が認められたのに対し、azoxybacilin処理細胞から調整した粗抽出画分ではその結合活性が減少していた。また、azoxybacilin処理によってCbfIpの蛋白量は変化しなかった。 ここまでの実験結果をまとめて、azoxybacilinによるSulfate assimilation pathway関連遺伝子の転写抑制機構の仮説を立て、図表4に示した。 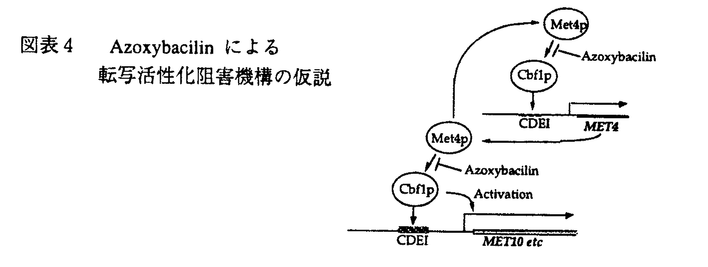 図表4 Azoxybacilinによる転写活性化阻害機構の仮説 図表4 Azoxybacilinによる転写活性化阻害機構の仮説 このように、azoxybacilinは新しい作用機作を含め微生物学的特徴を有するが、深在性真菌症に高い効果を発揮する上での1つの問題点は動物体内に存在するmethionineによる拮抗である。Methionineによる拮抗の原因が、methionine permeaseを介して細胞内へ透過する事である事を明らかにし、これを回避するためにエステル体を合成したところ、azoxybacilinに比べ、in vitroにおいてmethionine拮抗は減少し、動物感染モデルにおいても、明らかに強い延命効果を示した。すなわち、エステル化によってmethionineによる拮抗を軽減するという試みは成功したと言える。 このように、我々は、新しい作用機作をもつ抗真菌剤の創薬法に一つのアプローチを示した。 |