導入:細胞膜受容体に持続的な刺激を与えると、多くの場合、次に続く刺激に対する反応が減弱する現象が見られ、脱感受性(desensitization)と呼ばれる。この脱感受性は、G蛋白質共役受容体の場合、膜表面受容体の発現の減少、リガンド結合の減少、G蛋白質との共役機能の減少、またはG蛋白質より下流の成分の修飾によって起こる。このうち、受容体レベルでの脱感受性は、長期のプロセスと短期のプロセスとに分けて考えられている。短期の脱感受性は、アゴニストの結合直後の数分以内に起こり、回復に蛋白質合成が不要である。これには受容体とG蛋白質との脱共役(uncoupling)や受容体の細胞内への取り込み(sequestration)が含まれる。一方、長時間のアゴニスト刺激では、受容体総数の減少(down regulation)が生じ、回復には蛋白質合成が必要となる。短期の脱感受性には2つの異なる機構があり、1つは、同種脱感受性であり、特定の受容体刺激により、その受容体の刺激を介する反応のみが減少する。もう1つは異種脱感受性であり、1種類の受容体刺激により他の受容体刺激での反応も減少し、セカンドメッセンジャーによる調節を受ける。G蛋白質共役受容体キナーゼ(GRK)は、G蛋白質共役受容体を基質とし、アゴニストで活性化された受容体を特異的にリン酸化して、受容体の機能を調節している。ロドプシンキナーゼと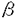 -アドレナリン受容体キナーゼ( -アドレナリン受容体キナーゼ(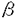 ARK)がその代表的な例で、それぞれ光あるいはアゴニストにより活性化されたロドプシンあるいは ARK)がその代表的な例で、それぞれ光あるいはアゴニストにより活性化されたロドプシンあるいは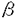 -アドレナリン受容体の細胞内C末端領域をリン酸化する。受容体がリン酸化されると、さらにそれぞれアレスチンあるいは -アドレナリン受容体の細胞内C末端領域をリン酸化する。受容体がリン酸化されると、さらにそれぞれアレスチンあるいは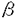 -アレスチンが受容体に結合することによって、G蛋白質との共役が阻害されるものと考えられている。 -アレスチンが受容体に結合することによって、G蛋白質との共役が阻害されるものと考えられている。 ブタ大脳(m1サブタイプが多い)や心臓(m2サブタイプのみ)から精製したムスカリン受容体はいずれも、受容体キナーゼによって、アゴニスト依存性にリン酸化される。このリン酸化は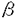 ARKによるものと同様の性質を示したことから、 ARKによるものと同様の性質を示したことから、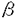 ARKまたは類似のキナーゼを介しているものと考えられた。なお、m2サブタイプのムスカリン受容体は、 ARKまたは類似のキナーゼを介しているものと考えられた。なお、m2サブタイプのムスカリン受容体は、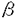 アドレナリン受容体と異なり、細胞内C末ループが短く、第3細胞内ループが長い構造をとっている。そこで、私はムスカリン受容体キナーゼによるm2サブタイプのムスカリン受容体のリン酸化部位の局在の検討を行った。 アドレナリン受容体と異なり、細胞内C末ループが短く、第3細胞内ループが長い構造をとっている。そこで、私はムスカリン受容体キナーゼによるm2サブタイプのムスカリン受容体のリン酸化部位の局在の検討を行った。 方法と結果:バキュロウイルスで発現させたヒトm2受容体を精製してリン脂質に再構成させ、アゴニストおよびG蛋白質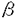 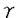 サブユニット存在下に、ブタ大脳より部分精製した受容体キナーゼでリン酸化した。精製m2受容体には59kDaと39kDaの成分が含まれており、両者ともアゴニストのカルバミルコリン存在下でリン酸化された。59kDaと39kDaのいずれの成分もムスカリン性不可逆的リガンド[3H]propylbenzilylcholine mustard(PrBCM)を結合した。39kDa成分は受容体の分解産物と考えられた。 サブユニット存在下に、ブタ大脳より部分精製した受容体キナーゼでリン酸化した。精製m2受容体には59kDaと39kDaの成分が含まれており、両者ともアゴニストのカルバミルコリン存在下でリン酸化された。59kDaと39kDaのいずれの成分もムスカリン性不可逆的リガンド[3H]propylbenzilylcholine mustard(PrBCM)を結合した。39kDa成分は受容体の分解産物と考えられた。 これら32Pあるいは[3H]PrBCM標識ペプチドをN-グリカナーゼで処理すると59kDaが52kDaに、39kDaが32kDaに、いずれも分子量が6-7kDa低下し、両ペプチドは糖鎖の結合が知られているN末端を含むことが示された。よって39kDaのペプチドは、59kDaペプチドのC末端領域約20kDaを欠失した成分であり、またm2受容体のアミノ酸残基298から312の領域に相当する合成ペプチドに対する抗体と反応したことから、受容体蛋白のN末端付近からアミノ酸残基312番目付近までの領域からなることが示された。 59kDa、39kDaペプチドの[3H]PrBCMと32Pの標識率を比較した。59kDaの[3H]PrBCM標識率は73.8%、32p標識率は71.6%であった。両ペプチドで[3H]PrBCMと32Pの標識率が等しいことから、全てのリン酸化部位はN末端から39kDaの領域に存在することが明らかとなった。 次に、取り込まれる[32P]リン酸の量を測定したところ[3H]QNB結合サイトあたり最大10-11個であった。リン酸化アミノ酸分析によりホスホセリンとホスホスレオニンが検出された。またホスホセリンの比率は59kDaペプチドで71.9%、39kDaペプチドでも68.5%であり、受容体あたり7-8個のセリンと3-4個のスレオニンがリン酸化されることがわかった。 さらにV8プロテアーゼ処理による検討を行った。0.5mg/mlで10分間処理すると[3H]PrBCM標識の59kDaペプチドはほとんど全てが32kDaに変換した。一方、同様の処理において[32P]リン酸化受容体では59kDaペプチドは32kDaと低分子量の複数のペプチドに変換した。このとき約17%の[32P]リン酸のみが59kDaから32kDaに変換した。32kDaバンドはN-グリカナーゼ処理により26kDaになることからN末端を含むことがわかった。この32kDaペプチドのリン酸化アミノ酸分析を行ったところ、ホスホセリンのみを含んでいた。これはセリン残基は含まずスレオニン残基を含む第2細胞内ループはリン酸化を受けないことを意味する。そしてN末端から32kDaと39kDaの間の領域に残りの8-9個のリン酸化部位が存在することが示された。さらに高濃度、長時間のV8プロテアーゼ処理により、[3H]PrBCM標識の59kDaペプチドは32kDaから30kDaと23kDaに、さらには28kDa、18kDaと13kDaのバンドへと変換したが、13kDa以下のバンドは認められなかった。[32P]リン酸化受容体では59kDaペプチドは32kDaと低分子量の複数のペプチドに変換したが、30KDa、28kDa、23kDa、18kDa、13kDaのバンドは認められなかった。これらから32kDaペプチド内の2個のリン酸化部位はN末端から30kDaと32kDaの間の領域に存在すると考えられる。以上の結果より第3細胞内ループの中央部分に相当するアミノ酸残基232-251の領域で2個のセリン残基が、アミノ酸残基271-311の領域で5-6個のセリン残基と3-4個のスレオニン残基がリン酸化されることが示唆された。 上記の領域を含むペプチド(アミノ酸残基227-324)とGST(glutatione Stransferase)の融合蛋白質を作成し、受容体キナーゼによるリン酸化を行った。この融合蛋白質は受容体キナーゼによりリン酸化を受け、そのリン酸化は受容体キナーゼ特異的阻害剤ヘパリンにより阻害された。 考察:G蛋白質共役型の受容体を基質とし、アゴニストにより活性化された受容体を特異的にリン酸化する一連の酵素として、哺乳類ではGRK1からGRK6までが知られており、総称してG蛋白質共役受容体キナーゼ(GRK)と呼ばれる。m2受容体はGRK2(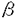 ARK1)、GRK3( ARK1)、GRK3(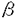 ARK2)、GRK5により、m3受容体はGRK2とGRK3でリン酸化されることが報告されている。用いたムスカリン受容体キナーゼはGRK2もしくは類似のキナーゼと考えられるが、m2受容体と他の基質間でリン酸化部位における共通の配列は認められなかった。一方、リン酸化部位の近傍に酸性のアミノ酸がある場合によい基質になるという報告と本研究の結果はよく合致した。m2受容体と同様に ARK2)、GRK5により、m3受容体はGRK2とGRK3でリン酸化されることが報告されている。用いたムスカリン受容体キナーゼはGRK2もしくは類似のキナーゼと考えられるが、m2受容体と他の基質間でリン酸化部位における共通の配列は認められなかった。一方、リン酸化部位の近傍に酸性のアミノ酸がある場合によい基質になるという報告と本研究の結果はよく合致した。m2受容体と同様に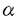 2-アドレナリン受容体のリン酸化部位も第3細胞内ループ中央部分と報告されており、C末端にリン酸化を受ける 2-アドレナリン受容体のリン酸化部位も第3細胞内ループ中央部分と報告されており、C末端にリン酸化を受ける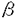 -アドレナリン受容体とは異なっている。GRK2は、受容体のどの部分をリン酸化するかについて特異的でないことがわかる。ただ、これらのリン酸化部位はいずれも受容体の膜貫通領域から離れた位置に存在するためリガンドやG蛋白質との作用部位とは重ならないと思われる。実際GRK2により精製m2受容体をリン酸化してもG蛋白質Gi/Go活性化能は変化しないと報告された。他の実験系においては活性化能の部分的低下が示されているため、リン酸化受容体が脱共役を起こすには -アドレナリン受容体とは異なっている。GRK2は、受容体のどの部分をリン酸化するかについて特異的でないことがわかる。ただ、これらのリン酸化部位はいずれも受容体の膜貫通領域から離れた位置に存在するためリガンドやG蛋白質との作用部位とは重ならないと思われる。実際GRK2により精製m2受容体をリン酸化してもG蛋白質Gi/Go活性化能は変化しないと報告された。他の実験系においては活性化能の部分的低下が示されているため、リン酸化受容体が脱共役を起こすには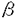 -アレスチンのような成分を必要とする可能性が考えられている。 -アレスチンのような成分を必要とする可能性が考えられている。 今回局在を明らかにしたリン酸化領域を含む第3細胞内ループ中央部分ペプチドの融合蛋白質(I3-GST)のリン酸化がマストパランと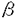  サブユニットにより相乗的に活性化されることが報告された。マストパランの効果はm2受容体の第4、第6、第7膜貫通部位直下に相当するペプチドでも再現される。また13-GSTのリン酸化は、 サブユニットにより相乗的に活性化されることが報告された。マストパランの効果はm2受容体の第4、第6、第7膜貫通部位直下に相当するペプチドでも再現される。また13-GSTのリン酸化は、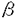 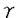 サブユニットとm2受容体あるいはリン酸化部位欠損変異受容体の存在下でアゴニスト依存性に促進されると報告された。したがって、アゴニストの結合したm2受容体の細胞膜直下部分とGRK2との相互作用とともに、G蛋白質 サブユニットとm2受容体あるいはリン酸化部位欠損変異受容体の存在下でアゴニスト依存性に促進されると報告された。したがって、アゴニストの結合したm2受容体の細胞膜直下部分とGRK2との相互作用とともに、G蛋白質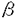 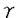 サブユニットとGRK2のPHドメインを含む領域での結合が協調してアゴニスト依存性のリン酸化を促進するものと推測されている。 サブユニットとGRK2のPHドメインを含む領域での結合が協調してアゴニスト依存性のリン酸化を促進するものと推測されている。 m2受容体の第3細胞内ループ中央部分の欠損あるいはセリン・スレオニンのアラニンへの置換によって受容体の細胞内移行が阻害されると報告された。またCOS細胞に発現させたm2受容体の細胞内移行がGRK2共発現により促進され、GRK2 dominant negative変異体の共発現により阻害されることも報告されている。 本研究の結果は、ムスカリン受容体におけるアゴニスト依存性リン酸化の機序およびリン酸化による受容体の機能調節を研究する上での基礎的情報を与えるものであり、細胞膜受容体機能の制御におけるリン酸化の役割についてのより詳細な検討を促進するものである。 |