本研究は高等動物の脳において運動機能の制御を担う大脳基底核の中で、重要な役割を演じていると考えられる線条体中型有棘神経細胞(medium spiny neuron:以下MSNと略す)を中心とするシナプス機構を明らかにするため、ラット線条体切片標本を用いて、MSNに入力するグルタミン酸作動性とGABA作動性のシナプス伝達の電気生理学的解析を試みたものであり、下記の結果を得ている。 1.MSNに入力するグルタミン酸作動性シナプス伝達に対して素量解析を試みたところ、大きさが大きく異なる2種類のシナプス入力が存在することが示された。一つは、その興奮性シナプス後電流(EPSCs)の大きさが10pAを越えることがないタイプ、もう一つはEPSCsの平均振幅が前者の10倍以上大きいタイプである。本研究において前者をS-type(smallの意)、後者をH-type(hugeの意)と名付けた。 2.S-typeシナプスは、EPSCsの素量の大きさ(約4-5pA)、failureの頻度(約0.6)など電気生理学的解析結果と従来から知られる線条体の解剖学的知見より、大脳皮質から入力するシナプスであることが示唆された。 3.H-typeシナプスは、そのEPSCsが線条体内刺激でpolysynapticに誘発されることから線条体内の神経細胞に由来することが推察され、グルタミン酸作動性interneuronが線条体内に存在することが示唆された。 4.EPSCsのpaired-pulse depression(PPD)を、S-typeとH-typeにわけて比較解析したところ、S-type EPSCsのPPDは刺激間隔を100ms以上にすると観察されないのに対し、H-type EPSCsでは150msの刺激間隔においてなお、2nd EPSCの振幅が1st EPSCに比して約50%抑制されることが示された。このことはs-typeとH-typeが異なるシナプス前繊維に由来することを支持すると考えられた。 5.MSNに入力するGABA作動性シナプス伝達の調節機構を解析するにあたり、本研究では、神経調節因子アデノシンの受容体サブタイプの一つ、アデノシンA2a受容体が、脳内においては線条体のMSNに高濃度かつ特異的に分布していることに着目し、A2a受容体機能のGABA作動性シナプス伝達への関与を検討した。アデノシンA2a受容体作動薬CGS21680(0.3-10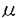 M)はGABA作動性の抑制性シナプス後電位(IPSPs)及び電流(IPSCs)の振幅を最大約60%まで濃度依存的に抑制した。この抑制はA2a受容体拮抗薬KF17837(0.1-1 M)はGABA作動性の抑制性シナプス後電位(IPSPs)及び電流(IPSCs)の振幅を最大約60%まで濃度依存的に抑制した。この抑制はA2a受容体拮抗薬KF17837(0.1-1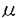 M)により濃度依存的に拮抗されたが、Al受容体拮抗薬ではなんら影響を受けなかった。KF17837は単独3 M)により濃度依存的に拮抗されたが、Al受容体拮抗薬ではなんら影響を受けなかった。KF17837は単独3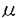 M以上の濃度でIPSCsの振幅を増大させた。これらの結果から、線条体アデノシンA2a受容体を介してMSNに入力するGABA作動性シナプス伝達を抑制する調節機構の存在と内在性のアデノシンがこの調節機構を担っていることが示された。 M以上の濃度でIPSCsの振幅を増大させた。これらの結果から、線条体アデノシンA2a受容体を介してMSNに入力するGABA作動性シナプス伝達を抑制する調節機構の存在と内在性のアデノシンがこの調節機構を担っていることが示された。 6.MSNで発生する自発微小抑制性シナプス後電流(mIPSCs)を解析したところ、CGS21680はmIPSCsの発生頻度を約60%まで抑制し、逆にKF17837は約140%まで増大させたが、両薬物共にmIPSCsの平均振幅や振幅の分布に影響をおよぼさなかった。これらの結果より、A2a受容体による調節は、前シナプスからのGABAの遊離を抑制することにより起こっていることが示された。A2a受容体がMSNに局在していることから、この調節はMSN間で形成されるGABA作動性feed back回路で特異的に起こっていることが考えられた。 以上、本論文は、ラット線条体切片標本において、MSNに入力するシナプス伝達の電気生理学的解析から、MSNへの2種類のグルタミン酸作動性シナプス入力の存在とグルタミン酸作動性interneuronが線条体内に存在する可能性を明らかにした。また、アデノシンによる線条体GABA作動性抑制性回路の調節機構の存在を明らかにした。本研究はなお不明な点の多い線条体シナプス機構とその大脳基底核の運動機能制御への寄与のさらなる解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |