プログラム細胞死という過程を通して細胞が除去される現象は、物理的・化学的要因で引き起こされる不慮の死とは異なり、その細胞の死はあらかじめ予定されている。例えば、免疫系におけるB細胞やT細胞の分化成熟過程では、Igを産生しないB前駆細胞,自己反応性T細胞や未熟B細胞等の除去が起こっている。このような細胞の死に方、即ちアポトーシスの研究は、癌や免疫系を含めさまざまな疾患の治療にも結び付くことが期待される。 近年アポトーシスに係わる多くの分子が同定されてきたが、特に免疫系においてB細胞リンパ腫の癌遺伝子であるbcl-2遺伝子はアポトーシスを抑制する働きから従来とは異なった癌遺伝子としての特徴を示し、アポトーシス研究が広まる中心的なきっかけとなった。細胞が他の細胞を積極的に殺す現象として認められる免疫系におけるアポトーシスは、例えば細胞障害性Tリンパ球やNK細胞が、ウィルスに感染した細胞や癌細胞に対しアポトーシスを誘導する。細胞障害性Tリンパ球やNK細胞表面上のエフェクター分子、或いはそれらエフェクター細胞によって産生される可溶性エフェクター分子が細胞死のターゲッティングに関係しているが、このようなエフェクター分子の受容体となる細胞表面上の抗原分子は、Fas抗原を始め、TNF-R,NGF-R,CD40,CD27,CD30等が知られており、これらの分子はその構造特徴からファミリー(NGF/TNFレセプタースーパーファミリー)を形成している。アポトーシスのシグナルは、エフェクター分子であるFasリガンド(Fas-L)やCD40リガンド(CD40-L)がFas,CD40に結合し細胞内に伝わって行き、最終的にシグナルを受けた細胞がアポトーシスを起こしたり、或いはBcl-2の関与によりアポトーシスが抑制されるが、レセプターからのシグナルが細胞内でどのように伝達されていくかについてはわかっていない。そこで、これらアポトーシスに深く関与する3つの分子(Fas,CD40,Bcl-2)にそれぞれ結合しシグナルの受け渡しをする分子,或いは調節する分子を単離同定し、アポトーシスのシグナル伝達機構解明の一助とすることを目的に本研究を行った。 Fas機能の調節蛋白をコードするcDNAは酵母2ハイブリッド系を用いてクローニングした。即ち、Fasの細胞質ドメインをLexA DNA結合ドメインに融合し、LexAオペレーターの支配下にあるHIS3及び -galactosidase活性を指標に、VP16の活性化ドメインに融合したランダムなマウスcDNAをスクリーニングした。得られた互いにオーバーラップする2クローンは、蛋白チロシンフォスファターゼ(PTB-BASと呼ばれる)ヒトcDNAと95%の相同性を示した。PTB-BASは、蛋白質の相互作用に関与し、細胞内骨格に対し蛋白を配位したり酵素活性を調節していると言われるGLGFからなる繰り返し構造を6個有しているが、得られたクローンはこのGLGFリピートの3番目に位置していた。従ってこのドメインはFasの細胞質ドメインと特異的な相互作用をしており、PTB-BASはFasに関係したフォスファターゼであると考えられる(以降FAP-1と称する)。FAP-1のGLGF3ドメインが結合する位置は、FasのC末端の15アミノ酸、即ち負の調節ドメインに限定されたが、このことはPTP-BASがアポトーシスを誘導するFasのシグナルを阻害している可能性を示唆する。確かにFAP-1遺伝子は、Fasが介在する細胞死に対して比較的耐性である組織や細胞株において強く発現していた。また、FAP-1遺伝子をT細胞へ導入すると、Fasで誘導されるアポトーシスが部分的に消失した。これらのことよりFAP-1はFasで誘導されるアポトーシスの負の調節因子であることが示唆された。Fasによるアポトーシスは、T細胞内の蛋白が早いリン酸化を受けること、また蛋白リン酸化酵素(PKC)阻害剤によってブロックされることから、今後明らかにされるであろうPKCとFAP-1間の相反する作用によって調節されていると考えられる。 -galactosidase活性を指標に、VP16の活性化ドメインに融合したランダムなマウスcDNAをスクリーニングした。得られた互いにオーバーラップする2クローンは、蛋白チロシンフォスファターゼ(PTB-BASと呼ばれる)ヒトcDNAと95%の相同性を示した。PTB-BASは、蛋白質の相互作用に関与し、細胞内骨格に対し蛋白を配位したり酵素活性を調節していると言われるGLGFからなる繰り返し構造を6個有しているが、得られたクローンはこのGLGFリピートの3番目に位置していた。従ってこのドメインはFasの細胞質ドメインと特異的な相互作用をしており、PTB-BASはFasに関係したフォスファターゼであると考えられる(以降FAP-1と称する)。FAP-1のGLGF3ドメインが結合する位置は、FasのC末端の15アミノ酸、即ち負の調節ドメインに限定されたが、このことはPTP-BASがアポトーシスを誘導するFasのシグナルを阻害している可能性を示唆する。確かにFAP-1遺伝子は、Fasが介在する細胞死に対して比較的耐性である組織や細胞株において強く発現していた。また、FAP-1遺伝子をT細胞へ導入すると、Fasで誘導されるアポトーシスが部分的に消失した。これらのことよりFAP-1はFasで誘導されるアポトーシスの負の調節因子であることが示唆された。Fasによるアポトーシスは、T細胞内の蛋白が早いリン酸化を受けること、また蛋白リン酸化酵素(PKC)阻害剤によってブロックされることから、今後明らかにされるであろうPKCとFAP-1間の相反する作用によって調節されていると考えられる。 FAP-1cDNAのスクリーニングと同様な手法を用いることにより、CD40の細胞質ドメインに結合する蛋白のcDNAを取得した。即ち、CD40の細胞質ドメインをLexA DNA結合ドメインに融合し、LexAオペレーターの支配下にあるHIS3及び -galactosidase活性を指標に、Gal4 trans-activationドメインに融合したランダムなヒトB細胞cDNAをスクリーニングした。B細胞表面抗原であるCD40は、B細胞の増殖とアポトーシス,免疫グロブリンのクラススイッチ,記憶細胞の産生,サイトカイン遺伝子の発現調節や細胞接着等に関係している。CD40の細胞質ドメインは、Fasの他、p75-NGF-R,TNF-R1とも緩い相同性を有するが、FasとTNF-R1のこの領域が細胞死のシグナル誘導に要される一方、CD40とp75-NGF-Rは逆にアポトーシスを阻害する。得られたcDNAにコードされる蛋白(CAP-1)は、そのC末端側のドメインに、TNF-R2の細胞質領域に結合する蛋白質として同定されたTRAF1,TRAF2と強い相同性を有する領域を含んでいた。また、この領域だけでCAP-1のCD40への結合、及びホモダイマー化に十分であった。従って、CAP-1は少なくとも既知或いは未知のTRAFファミリーのメンバーとのヘテロダイマー化も予想される。このようなホモ及びヘテロの二量体の様々な組合わせができるとすれば、これによりTRAF-ドメイン遺伝子ファミリーのメンバーによる遺伝子発現レベル、及びTRAF-ドメインを含む蛋白とTNF-Rファミリーのメンバー間の蛋白-蛋白の相互作用のレベルの両方によってコントロールされるシグナル伝達の応答に対して特異性が与えられると考えられる。CAP-1のN末端は、先のTRAF1,TRAF2と同様にDNA或いはRNAと作用するような転写因子等に認められるRING-finger,zinc-finger様ドメインを有しており、CAP-1は潜在的なシグナル伝達蛋白ファミリーの新しいメンバーであることが示唆された。 -galactosidase活性を指標に、Gal4 trans-activationドメインに融合したランダムなヒトB細胞cDNAをスクリーニングした。B細胞表面抗原であるCD40は、B細胞の増殖とアポトーシス,免疫グロブリンのクラススイッチ,記憶細胞の産生,サイトカイン遺伝子の発現調節や細胞接着等に関係している。CD40の細胞質ドメインは、Fasの他、p75-NGF-R,TNF-R1とも緩い相同性を有するが、FasとTNF-R1のこの領域が細胞死のシグナル誘導に要される一方、CD40とp75-NGF-Rは逆にアポトーシスを阻害する。得られたcDNAにコードされる蛋白(CAP-1)は、そのC末端側のドメインに、TNF-R2の細胞質領域に結合する蛋白質として同定されたTRAF1,TRAF2と強い相同性を有する領域を含んでいた。また、この領域だけでCAP-1のCD40への結合、及びホモダイマー化に十分であった。従って、CAP-1は少なくとも既知或いは未知のTRAFファミリーのメンバーとのヘテロダイマー化も予想される。このようなホモ及びヘテロの二量体の様々な組合わせができるとすれば、これによりTRAF-ドメイン遺伝子ファミリーのメンバーによる遺伝子発現レベル、及びTRAF-ドメインを含む蛋白とTNF-Rファミリーのメンバー間の蛋白-蛋白の相互作用のレベルの両方によってコントロールされるシグナル伝達の応答に対して特異性が与えられると考えられる。CAP-1のN末端は、先のTRAF1,TRAF2と同様にDNA或いはRNAと作用するような転写因子等に認められるRING-finger,zinc-finger様ドメインを有しており、CAP-1は潜在的なシグナル伝達蛋白ファミリーの新しいメンバーであることが示唆された。 Bcl-2蛋白は、アポトーシスの最終ステップを抑制する働きをしているが、そのの生化学的な作用メカニズムは、その推定アミノ酸配列が既に機能がわかっている他の蛋白とホモロジーが無いことからまだ不明である。Bcl-2に結合する蛋白質に関してはこれまで様々な分子が同定されている。これらBcl-2ファミリーはお互いに一定のペアでダイマーを作り、これらによってアポトーシスが制御されている。本研究ではバキュロウィルスから調製した組換えヒトBcl-2蛋白とそのモノクローナル抗体を用いた免疫化学的方法により、マウス胎児cDNAライブラリーからBcl-2に結合する新しい蛋白質(BAG-1)を同定した。BAG-1蛋白は、これまで知られているホモ及びヘテロダイマーを形成し得るBcl-2或いは他のBcl-2ファミリーの蛋白の範疇には入らなかった。ヒトリンパ腫細胞株Jurkatを用いた遺伝子導入実験において、BAG-1とBcl-2の同時発現は、BAG-1或いはBcl-2の単独発現に比べ、staurosporine,抗Fas抗体,細胞障害性T細胞等の刺激による細胞死に対する抵抗性を著しく高めた。BAG-1遺伝子でトランスフェクトした3T3 fibroblastもアポトーシスを誘導する刺激に対し生き残った。BAG-1蛋白は、蛋白-蛋白の認識に関係していることが推定されているユビキチン様蛋白ドメインを有しており、Bcl-2やBcl-2結合蛋白を細胞死の調節に関与するプロテアーゼを含む蛋白複合体と接触させる役割、即ちプロテアーゼの標的蛋白としてこれらを認識させる役割を果たしているものとも考えられる。bag-1は新しいタイプの細胞死に対抗するする遺伝子であり、これまでBcl-2に依存しない経路によるものとされてきたアポトーシス誘導のいくつかのルートはBcl-2とBAG-1の組合わせが必要だった可能性が示唆された。 本研究で同定したFAP-1,CAP-1,BAG-1の機能をモデルとして図に示した。 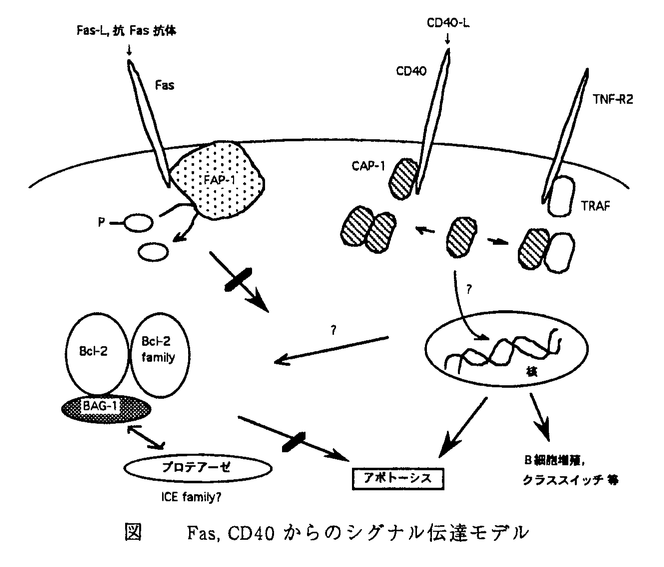 図 Fas,CD40からのシグナル伝達モデル 図 Fas,CD40からのシグナル伝達モデル Fas,CD40を介したアポトーシスのシグナルはFAP-1,CAP-1の介在を経た後Bcl-2ファミリーの関与を受けると考えられるが、今のところICE(IL-1 -converting enzyme)或いはICEファミリーの活性化によりアポトーシスに至ること明らかになっている。BAG-1に含まれていたユビキチン様ドメインとICEとの関係の有無等を含め、次の新しい分子の発見、及び相互作用する種々の分子との関わりを解明することによって、アポトーシスのシグナル伝達解明が進んで行くものと期待される。アポトーシスに関係する蛋白質に結合するこれらの蛋白質の機能に関してはまだ断片的なデータしか得られていないものの、少なくともFas,CD40,Bcl-2等は各々のシグナル伝達分子を介して調節し合いアポトーシスをコントロールしている。各分子の機能付け、新しい分子の相互制御機構の解析を通してアポトーシスのシグナル伝達系が明らかになることにより、様々な疾患の診断や治療に寄与できる知見が得られて行くであろう。 -converting enzyme)或いはICEファミリーの活性化によりアポトーシスに至ること明らかになっている。BAG-1に含まれていたユビキチン様ドメインとICEとの関係の有無等を含め、次の新しい分子の発見、及び相互作用する種々の分子との関わりを解明することによって、アポトーシスのシグナル伝達解明が進んで行くものと期待される。アポトーシスに関係する蛋白質に結合するこれらの蛋白質の機能に関してはまだ断片的なデータしか得られていないものの、少なくともFas,CD40,Bcl-2等は各々のシグナル伝達分子を介して調節し合いアポトーシスをコントロールしている。各分子の機能付け、新しい分子の相互制御機構の解析を通してアポトーシスのシグナル伝達系が明らかになることにより、様々な疾患の診断や治療に寄与できる知見が得られて行くであろう。 |