肝細胞は、薬剤による肝障害あるいは部分肝切除によって引き起こされる肝細胞の喪失に反応して、増殖する。肝細胞増殖因子及び上皮細胞増殖因子は、ともに肝細胞に作用し、部分肝切除後、肝再生の引き金を引くと考えられている。しかしながら、肝の代償性増殖の調節機構は、まだ十分解明されていない。種々の増殖因子のシグナル伝達に、燐酸化脱燐酸化酵素が深く関与している。 細胞周期のG1通過は、サイクリン及びサイクリン依存プロテインキナーゼにより調節される。その作用は、網膜芽細胞腫蛋白質(pRb)やp53のような癌抑制蛋白質により介され、pRbやp53の活性は、それらの燐酸化状態に依存している。 K252aが、プロテインキナーゼC、cAMP依存プロテインキナーゼ、cGMP依存プロテインキナーゼ、及びミオシン軽鎖キナーゼ、カルシウム・カルモデュリン依存プロテインキナーゼIIを抑制すること、ラット線維芽細胞で、細胞分裂を迂回してDNA再合成を引き起こし、4倍体細胞を生じることが、最近見いだされた。 本研究では、蛋白質燐酸化酵素の細胞周期における役割を解明する目的で、様々な蛋白質燐酸化酵素阻害剤の、様々な細胞の細胞増殖に及ぼす影響を検討した。 HuH7ヒト肝癌細胞への200nM K252aの投与は、細胞の増殖をほぼ完全に抑制した。[3H]チミヂンの取り込みは抑制され、フローサイトメトリーは、100nM K252a処理3日後に、2Cにただ1つだけピークを示した。細胞癌遺伝子c-mycの発現は、減じなかった。このG1阻止に拘わらず、細胞はK252a処理に続く3日で、細胞の大きさと細胞蛋白質量を、ともに4倍に増加した。一方細胞は、通常のように培地中にアルブミンと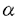 フェトプロテインを分泌した。 フェトプロテインを分泌した。 これらの結果は、K252aが、G1期で細胞周期を阻止することによって、その機能を失うことなく、HuH7の細胞の大きさを増加しうることを示し、抗癌剤の補助薬としてのK252aの可能性を示唆する。 他方K252aは、HOSヒト骨肉腫細胞に細胞質分裂を迂回して、DNA再合成を誘発し、細胞の大きさを増加して、その結果多核細胞を生じえた。K252aは、プロテインキナーゼC、cAMP依存プロテインキナーゼ、ミオシン軽鎖キナーゼ等を阻害するので、特異的阻害剤であるKT5720及びwortmanninや、他の非特異的阻害剤であるスタウロスポリンを使用して、同様の実験を行った。しかしながら、これらはK252aと異なり、G1阻止と同時に機能抑制を伴い、巨大細胞の誘発を認めず、上記の結果は、K252aに特徴的な結果であった。 K252aは、HuH7肝癌細胞の増殖を抑制し、細胞周期のG1後期で、網膜芽細胞腫蛋白質(pRb)の十分な燐酸化を抑制した。しかしながら、K252aは、サイクリンD1、サイクリンE、サイクリンA、及びサイクリンEあるいはサイクリンAに結合したCdk2蛋白質の、レベルを変えなかった。一方、K252aは、HOS骨肉腫細胞に多核細胞を生じさせ、pRbの燐酸化を抑制しなかった。 K252aによるpRb燐酸化の抑制機構は、以下の三つの可能性が考えられる。先ず、K252aが、Cdk-サイクリン複合体を直接阻害していると考えられる。しかしながら、K252aにより、pRb燐酸化が抑制される細胞と抑制されない細胞がある。第二に、K252aが、p21などのCdk抑制因子を介して働いていると考えられる。しかしながら、HuH7とHOSのp53遺伝子に変異が報告されており、p21を介して働いている可能性は少ないと考えられる。最後に、まだ明らかでない機構によりpRb燐酸化を抑制していると考えられる。 以上の結果より、G1後期において、K252aによって細胞周期が阻止される細胞と、阻止されずにDNA再合成により多核になる細胞が、あることが示された。しかも、G1阻止は、pRbの燐酸化の抑制を伴い、Cdk-サイクリンにより介されるpRbの燐酸化の調節機構が、細胞により異なる可能性をも示唆し、細胞周期調節機構の解明に、新たな知見を与えるものである。 |