エンドセリン(Endothelin:ET)は、21アミノ酸残基から構成されるペプチドで、現在までに知られている中で最も強力な血管収縮作用を有する生理活性物質の一つである。ETは他の生体内システムとも複雑に相互作用しながら血圧調節に関与していると思われ、心血管系の恒常性を維持するために重要な役割を担っていると考えられる。その他局所ホルモンとして細胞増殖、塩分調節等の多彩な機能を有することが示唆されている。 ETには3種の異なる遺伝子にコードされるET-1,ET-2,ET-3の存在が知られており、ETファミリーを形成している。各ETのアミノ酸配列は種間で良く保存されている。ET-1は1988年に柳沢らによって、ブタ血管内皮細胞の培養上清中から発見され、その前駆体蛋白質のcDNAがクローニングされた。続いて筆者らは胎盤由来のヒトET-1前駆体蛋白質のcDNAをクローニングし、その構造から推定された前駆体のアミノ酸配列の解析により、ヒトとブタのET-1のアミノ酸配列が同一であることを見出した。またET配列のN末端側及びC末端側延長部に、それぞれプロセッシング部位と予想される塩基性アミノ酸対が存在し、ET-1には直接的な生成中間体として成熟型のETよりも分子量の大きいビッグエンドセリン(big endothelin:bigET)の存在が推定された。 本研究においては、初めにヒトET-1の生合成系について調べるため、ヒトET-1前駆体cDNAの腎由来COS-7細胞における発現実験を行い、予想通りbigET-1(1-38)からのET-1生成を示唆する知見を得た。また培養上清のHPLC分析によりCOS-7細胞がET-1及びET-2を産生することが示唆されたことから、各種動物の腎臓由来細胞株の培養上清を調べた結果、これらの細胞株がいずれもET様物質を産生することが分かり、ETが血管内皮細胞以外に腎臓由来細胞株においても産生、分泌されることを明らかにした。その中でET-2のみを産生するヒト腎腺癌由来ACHN細胞を見出し、それまで単離・同定されていなかったET-2を本細胞株から単離し、その存在を初めて明らかにした。また筆者らによりACHN細胞由来のヒトET-2前駆体蛋白質をコードするcDNA及び胎盤由来のヒトET-3前駆体蛋白質をコードするcDNAがクローニングされた。これらのcDNAの解析により、ET-2とET-3にもET-1と同様にbigETの存在が推定されたが、3種のbigETはそれぞれ異なるプロセッシング様式により生成することが予想された。特にbigET-2については、ACHN細胞の培養上清及びヒト血漿、尿の分析により前駆体アミノ酸配列から予想されたbigET-2(1-37)とは性状の異なる分子の存在が示唆され、その構造解明が待たれた。またbigET-3にも予想されたbigET-3(1-42)NH2以外の分子種の存在が示唆されていた。このような状況において、3種のヒトbigETの一次構造を明らかにし、ETの生成経路を解明することを目的として、上述のヒトET-1,ET-2,ET-3各前駆体蛋白質をコードするcDNAを恒常的に発現するCHO-K1(チャイニーズハムスター卵巣由来)細胞株を樹立し、その培養上清中から抗ET抗体を用いたアフィニティクロマトグラフィーと逆相HPLC及び各bigETを特異的に検出する3種類のEIAにより、bigET様免疫活性物質を精製し、N末端アミノ酸配列分析と質量分析を行うことにより、それらの構造をペプチド化学的に分析・同定した。 その結果、bigET-1をET-1前駆体のアミノ酸配列から予想された通りbigET-1(1-38)と同定した。bigET-2は予想されていたbigET-2(1-37)とは異なり、C末端にArgが一残基付加したbigET-2(1-38)であることを明らかにした。bigET-3は、C末端がアミド化されたbigET-3(1-41)NH2と同定した。またbigET-1には(1-38)以外の分子種は見出されなかったが、bigET-2及びbigET-3には(1-38)及び(1-41)NH2より分子量の大きい生成中間体がそれぞれ多量に存在することが分かった。これらのことはヒト血漿中及び尿中におけるbigET-1、bigET-2及びbigET-3様物質の存在様式と、良く一致していた。3種類のETは、各前駆体からのプロセッシングにより、上記bigETが生成された後、ET変換酵素の作用により切り出されて生成するものと考えられたが、プロセッシング様式はETごとに異なることが明らかになった(4頁図1,2,3)。 ETは急性腎不全、急性心筋梗塞、脳血管収縮等の様々な病態の増悪因子と考えられており、ET変換酵素の阻害によりETの産生を抑制することは、これらの病態の治療の方策として有用と考えられる。本研究において同定された3種類のbigETは、ET変換酵素の本来の基質として最適と考えられ、ETに特異的な生成阻害物質を探索するために有用と思われる。  図1.推定されたヒトET-1生合成経路bigET-1(1-38)は、その配列の両側に位置する典型的な塩基性アミノ酸対でのプロセッシングにより生成し、続いてET変換酵素によりET-1(1-21)が生成することが推測された。 図1.推定されたヒトET-1生合成経路bigET-1(1-38)は、その配列の両側に位置する典型的な塩基性アミノ酸対でのプロセッシングにより生成し、続いてET変換酵素によりET-1(1-21)が生成することが推測された。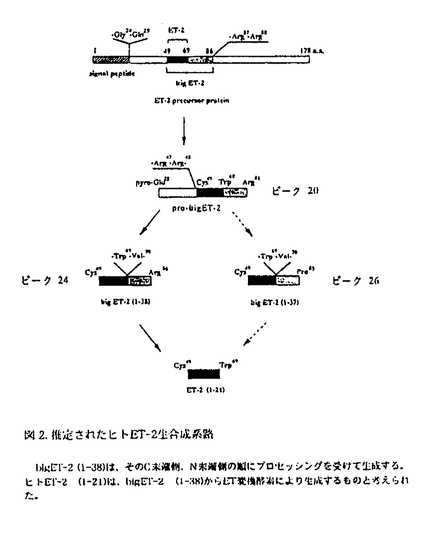 図2.推定されたヒトET-2生合成系路bigET-2(1-38)は、そのC末端側、N末端側の順にプロセッシングを受けて生成する。ヒトET-2(1-21)は、bigET-2(1-38)からET変換酵素により生成するものと考えられた。 図2.推定されたヒトET-2生合成系路bigET-2(1-38)は、そのC末端側、N末端側の順にプロセッシングを受けて生成する。ヒトET-2(1-21)は、bigET-2(1-38)からET変換酵素により生成するものと考えられた。 図3.推定されたヒトET-3生合成経路bigET-3(1-41)NH2は、その配列のN末端側、C末端側の順にプロセッシングを受けて生成される。ヒトET-3(1-21)は、bigET-3(1-41)NH2からET変換酵素により生成するものと考えられた。 図3.推定されたヒトET-3生合成経路bigET-3(1-41)NH2は、その配列のN末端側、C末端側の順にプロセッシングを受けて生成される。ヒトET-3(1-21)は、bigET-3(1-41)NH2からET変換酵素により生成するものと考えられた。 |