食餌中のタンパク質の量的あるいは質的変化に応答して体タンパク質の代謝状態が大きく変動することは古くから知られている。この現象に関する膨大な知見が集積する一方で、このような現象を引き起こす機構に関してはほとんど明らかにされていない。近年、インスリン様成長因子I(IGF-I)が体タンパク質の代謝状態を制御する重要な内分泌因子のひとつであることが明らかとなってきた。すなわち、血中のIGF-I濃度や肝臓におけるIGF-I mRNA量は食餌タンパク質の変化に伴って変動し、IGF-Iを投与することにより体タンパク質合成速度が上昇することが、多くの研究により示されてきた。そこで本研究では、このIGF-Iの生理活性が食餌中のタンパク質栄養によってどのように制御されているのかを解明することを目的とした。 IGF-Iは標的細胞表面のIGF-Iレセプター(IGF-IR)と結合して生理作用を発現することから、まず食餌タンパク質の量及び質の変化に伴う組織中のIGF-IRの発現の変動を検討した(第一章)。一方、体液中でほとんどのIGF-Iが特異的結合タンパク質(IGFBP:現在までにIGFBP-1,-2,-3,-4,-5,-6の6種類の存在が確認されている)と結合して存在し、中でも多くがIGFBP-3およびacid-labile subunit(ALS)と三量体を形成していることが既に広く知られている。そこで、食餌中のタンパク質の量及び質の変化に伴うIGFBPおよびALSの発現の変動を詳細に解析した(第二章、第三章)。その結果、食餌中のタンパク質量の低下により、肝臓のIGFBP-1 mRNAが顕著に増加し、この増加は必須アミノ酸の欠乏に応じたIGFBP-1遺伝子の転写活性の上昇により生じることが明らかとなった。この遺伝子発現誘導の分子機構を解明する目的で、IGFBP-1遺伝子のプロモーター領域における必須アミノ酸欠乏に対する応答領域の検索を行った(第四章)。 第一章食餌タンパク質の量及び質が各組織におけるIGF-IRの発現におよぼす影響 タンパク質として12%カゼイン、12%グルテンを含む餌(12C、12G)、および無タンパク質食(PF)を8日間成長期のラットに与え、精巣・心臓・肺・小腸・胃・腎臓・脳の各組織中のIGF-IR mRNA量をNorthern blotおよびdot bloy解析により、またIGF-IRの親和性および数をスキャッチャード解析により検討した。mRNA量は精巣と心臓において12G群とPF群で12C群に比べ有意に増加していたが、他の組織では変化は見られなかった。IGF-IRのIGF-Iとの親和性はいずれの組織でも変化がなかったが、IGF-IR数は胃において12G群とPF群で、12C群に比較して増加が観察された。このように、いくつかの組織でタンパク質栄養状態の悪化に伴うIGF-IRのup-regulationがみられたが、いずれの増加も2倍程度であった。これらの結果は、タンパク質栄養状態に応じて組織により異なる様式でIGF-IRの合成が変化しており、変動の認められる臓器では、タンパク質栄養状態の悪化に伴うIGF-IRの増加によりIGF-Iに対する感受性がやや上昇するものと考えられた。 第二章食餌タンパク質の量が各組織におけるIGFBPの合成におよぼす影響 12CおよびPFを摂取したラットより肝臓・腎臓・脾臓・小腸・精巣・脳・胃・心臓・肺を採取し、IGFBPおよびALS mRNAの組織分布および各食餌群でのmRNA量の変化をNorthern blot解析により検討した。IGFBP-2,-3,-6mRNAは広範な組織に分布していたが、IGFBP-1,-4,ALS mRNAは肝臓に、IGFBP-5mRNAは腎臓に局在していた。次に食餌条件の違いによる各種IGFB PmRNA量を測定したところ、肝臓においてPF群で12C群に比べてIGFBP-1mRNAが約6倍に、IGFBP-2mRNAが約2倍に増加することを初めて発見した。さらに、肝臓でのIGFBP-1,-2,-3,-4の遺伝子の転写速度をnuclear run-on assay法により測定した結果、PF群で12C群に比較してIGFBP-1,-2遺伝子の転写速度の上昇が認められた。以上の結果より、タンパク質栄養状態の悪化に伴いIGFBP-1,-2遺伝子の転写が誘導されることが明らかとなった。 第三章食餌タンパク質の質が肝臓におけるIGFBPの合成におよぼす影響 12C,12GおよびPFを摂取したラットの肝臓におけるIGFBP-1,-2,-3,-4mRNA量をNorthern blot解析により検討したところ、12G群ではPF群のようなIGFBP-1mRNA量の著しい増加は観察されなかった。そこで、IGFBP mRNA量に及ぼす食餌中の必須アミノ酸の影響をさらに詳細に解析する目的で、一種類の必須アミノ酸が欠乏あるいは制限された食餌、すべての必須アミノ酸あるいはすべてのアミノ酸が欠乏した食餌をアミノ酸混合食として調製後ラットに給餌し、肝臓におけるIGFBP mRNA量を測定した。その結果、肝臓のIGFBP-1およびIGFBP-2mRNA量は一種類のアミノ酸欠乏食あるいは制限食の給餌では増加しないが、全ての必須アミノ酸欠乏食および全てのアミノ酸欠乏食の給餌により著増することが初めて明らかとなった。この際、一種類の必須アミノ酸欠乏食を給餌した動物の体重減少は、全くアミノ酸を含まない食餌を与えた動物に比べて少なく、以上の結果は、全てのアミノ酸欠乏状態における著しい成長遅滞は、血中IGF-I濃度の低下に加えて、IGFBP-1濃度が上昇することにより引き起こされていることを示している。 第四章タンパク質栄養状態の変化がIGFBP-1遺伝子の転写におよぼす影響 先に述べたように、食餌タンパク質量の減少によって肝臓におけるIGFBP-1遺伝子の転写が誘導されることが明らかとなった。そこで、IGFBP-1遺伝子の転写制御領域に結合する核内因子が、食餌タンパク質量の減少に応答してどのように変化するかについて検討した。IGFBP-1遺伝子の5’領域約1000bpを断片化し、12CあるいはPFを給餌したラット肝臓中の因子との相互作用をgel shift assay法により調べた。その結果、-688〜-582,-274〜70,-70〜+114の3つの領域と結合する因子が検出され、このうち-70〜+114に結合する因子は、特異的抗体を用いた実験などにより肝臓特異的転写因子HNF-1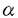 であると同定した。しかし、gel shift assayにおいては、いずれの因子も食餌条件の変化による明らかな差は観察されなかった。一方、肝臓由来の培養細胞H4IIEおよびHuH-7で、培地よりアミノ酸を除去することによりIGFBP-1mRNA量が増加すること、すなわちin vivoでのアミノ酸欠乏に対する応答を再現できることが明らかとなった。そこで、特にHuH-7細胞を用いて、培地中のアミノ酸除去に応答したIGFBP-1遺伝子5’領域のプロモーター活性の変動を、ルシフェラーゼをレポーター遺伝子として解析した。その結果、-70〜+114領域のみでもアミノ酸除去によるプロモーター活性の増加が観察され、この領域にIGFBP-1遺伝子のアミノ酸応答性エレメント(AARE;amino acid reponsive element)が存在することが示された。H4IIE細胞においても、この領域にはHNF-1 であると同定した。しかし、gel shift assayにおいては、いずれの因子も食餌条件の変化による明らかな差は観察されなかった。一方、肝臓由来の培養細胞H4IIEおよびHuH-7で、培地よりアミノ酸を除去することによりIGFBP-1mRNA量が増加すること、すなわちin vivoでのアミノ酸欠乏に対する応答を再現できることが明らかとなった。そこで、特にHuH-7細胞を用いて、培地中のアミノ酸除去に応答したIGFBP-1遺伝子5’領域のプロモーター活性の変動を、ルシフェラーゼをレポーター遺伝子として解析した。その結果、-70〜+114領域のみでもアミノ酸除去によるプロモーター活性の増加が観察され、この領域にIGFBP-1遺伝子のアミノ酸応答性エレメント(AARE;amino acid reponsive element)が存在することが示された。H4IIE細胞においても、この領域にはHNF-1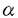 が結合しており、HNF-1がアミノ酸応答に関わる転写因子である可能性が考えられた。 が結合しており、HNF-1がアミノ酸応答に関わる転写因子である可能性が考えられた。 本研究により、食餌中のタンパク質の量的あるいは質的変化に応答した、IGF-Iの生理作用発現に関わる各分子の動態が総合的に明らかとなった。その結果、IGF-Iによる体タンパク質代謝制御機構を分子レベルで議論することが可能となった。すなわち、タンパク質栄養状態の悪化に対して、細胞表面のIGF-Iレセブターの発現は大きく変動しない。一方、IGF-IやIGFBP-3,-4の合成は大きく減少し、血中IGF-I濃度の低下や血中における寿命の短縮を引き起こす。さらに、IGFBP-1,-2の合成が著しく増加することによってIGFBP-1,-2と結合しているIGF-Iが増加し、IGF-Iとレセプターとの会合が抑制されると同時に、IGF-Iは血中からすみやかに代謝される。このようなIGFシステムの総合的な変化が、IGF-Iの活性を著しく弱め、その結果、動物の体タンパク質代謝活性の低下、ひいては成長の遅滞を引き起こすものと考えられる。 一方、食餌タンパク質の変化を生体が認識する機構に関しては、培養細胞を用いたIGFBP-1の転写調節機構の解析結果より、アミノ酸が直接信号の役割を果たす可能性が示された。IGFBP-1遺伝子の転写は、細胞に取り込まれるアミノ酸の変化に応答して制御され、IGFBP-1遺伝子上にその応答領域が存在することを示すことができた。本研究のように、食餌タンパク質の変化によるIGFBP-1遺伝子転写誘導の分子機構を明らかにすることは、生体が食餌成分であるアミノ酸を認識し、代謝の変化を引き起こすまでの機構を解明する観点から大きな意義があるものと考えられる。 |