学位論文要旨
| No | 213145 | |
| 著者(漢字) | 大槻,マミ太郎 | |
| 著者(英字) | ||
| 著者(カナ) | オオツキ,マミタロウ | |
| 標題(和) | ケラチンK5遺伝子の転写制御因子(AP2,Sp1を含む)について | |
| 標題(洋) | ||
| 報告番号 | 213145 | |
| 報告番号 | 乙13145 | |
| 学位授与日 | 1997.01.22 | |
| 学位種別 | 論文博士 | |
| 学位種類 | 博士(医学) | |
| 学位記番号 | 第13145号 | |
| 研究科 | ||
| 専攻 | ||
| 論文審査委員 | ||
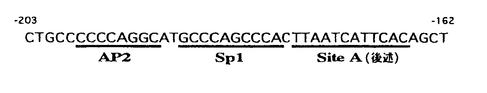
| 内容要旨 | 上皮細胞のサイトスケルトンであるケラチン中間径線維は,きわめて多様性に富んだ一群の蛋白質であるが,近年遺伝性水疱性皮膚疾患発症の原因がケラチン遺伝子の点突然変異に求められることが明らかになり,注目を集めているのは周知のとおりである。現在までにヒトの上皮細胞系では21種類のケラチン(K1〜K21)が知られているが,分子量と等電点の差によって塩基性(typeII)ケラチン群(K1〜K8)および酸性(typeI)ケラチン群(K9〜K21)に分類され,これらはケラチン目録として広く受け入れられている。そしてK9やK19など一部の例外を除いて,特定の塩基性ケラチンは特定の酸性ケラチンとペアで発現,即ちケラチン中間径線維は2つのsubfamilyからのヘテロダイマーを基本として形成されることが分かっている。 ケラチンペアの発現は細胞の種類,増殖,分化によって特異的に変化し,例えば重層扁平上皮であるヒト表皮の基底細胞では塩基性のK5と酸性のK14という1組のケラチン対(扁平上皮型)から成るが,分化した上層の有棘細胞では,K1とK10のペア(角化型)が発現されるようになる。一方乾癬や外傷後など,表皮増殖が刺激されている状態では,K1/K10の代わりにK6/K16(K17)という過増殖型ケラチンが発現されてくる。これらのケラチンは各々個別の遺伝子によって規定されており,塩基性ケラチン群は12番,酸性ケラチン群では17番染色体上にそれぞれクラスターとして位置しているが,このことは特異的なペアとしてのケラチン発現が単なる染色体上の位置関係によるものではないことを示唆し,主として転写レベルで何らかの共通の制御因子により調節されているものと推察されている。 筆者は以前より,ケラチン発現の転写レベルでの制御に焦点をあて,複数のケラチン遺伝子調節領域と核蛋白の相互作用について分析してきたが,とくにK5ケラチン遺伝子上流域(約900bp)を検討することにより,preliminaryに複数の核蛋白結合部位を同定した。そのうち最も下流の部位のすぐ近傍に塩基配列上AP2認識部位が同定され,その両者を含んだ約40bpのエレメントは,転写活性に極めて重要であることがトランスフェクション・アッセイにより示された。表皮細胞特異的な転写制御因子の候補として近年報告されたKER1,KTP-1はともにAP2との関連が示唆されているため,この比較的短い領域に結合して転写制御に関わる核蛋白の機能,独自性と相互作用について検討を試みたのが本稿の内容である。 筆者が焦点を当てた約40bpのエレメント(K5-203/-166)をプローブとし,種々の既知の転写因子結合部位のコンセンサス配列を有するオリゴヌクレオチドをコンペティターとして,HeLa細胞および正常ヒト表皮細胞から抽出した核蛋白を用いてゲルシフトを施行したところ,AP2とSp1オリゴはそれぞれコンペティションにより相異なるバンドを消失せしめることから,AP2とSp1両蛋白の結合が予想され,以後この40bpのエレメントをK5complexと呼ぶ。その塩基配列中にはSp1のコンセンサス配列は存在しないが,AP2部位のすぐ下流にGCCCAGCCCAというGC-richな領域があり,ゲルシフトを繰り返してK5Sp1結合部位をそこに同定した(下図)。 次にK5Sp1結合部位のみを含む短いオリゴをプローブとし,またSp1-specific antibodyを用いてスーパーシフトを施行したところ,転写因子Sp1そのものの結合と考えられるバンドは上のバンドのさらに上半分のみであり,他のものは影響を受けないことから,同部位にはSp1以外にも別の核蛋白が結合しうることが示唆された。さらに,やはり表皮のケラチンK16の遺伝子調節領域中に存在するSp1結合部位(こちらはコンセンサス配列)をプローブとしてK5Sp1結合部位と比較してみたところ,スーパーシフトにおいて両者は全く同一のパターンを呈し,しかも相互にコンペティションが認められた。この事実は,相異なるケラチン遺伝子の発現に共通の制御因子がしかも複数のグループとして関与するということを裏付ける意味で,初めての報告といえる。なお,ヒト・メタロチオネイン遺伝子においては,AP2およびSp1結合部位は事実上同じエレメントの中に重複して存在しているが,K5complexでは両結合部位は相互に依存せず,転写因子AP2およびSp1を各々個別に結合することが,それぞれの部位のみを含む短いオリゴをプローブとして行ったゲルシフトから結論された。 Sp1,とくにその上位のバンドは太く強力であり,他の蛋白結合の検出を妨げている可能性があるため,K5complexの中でSp1の部位のみ変異を作り,それをプローブとしてゲルシフトを行ったところ,Sp1特有のバンド・パターンは消失し,残存しているAP2のバンドより上位に新しいバンドが検出された。さらにAP2の箇所にも変異を作ってみると,AP2のバンドも消失したがこの新たなバンドのみは残り,結局これを以前preliminaryに命名したSite Aへの結合によるものと結論し,その結果Site AはAP2とSp1結合部位のすぐ下流に位置しており,K5complex中に新たな制御因子が結合してAP2,Sp1とin vivoにおいてクラスターを作る可能性が示唆された(図参照)。ただしin vitroのゲルシフトにおいては,複数の制御蛋白が実際にクラスターとなってK5complexのエレメントに同時に結合した複合体は検出されておらず,認められたバンドはすべて各蛋白単独の結合と考えられる-つまり蛋白は各々の部位においてin vitroでは相互排他的に結合するが,in vivoにおいてはエレメントに結合した制御因子にさらに作用する未知の安定化因子が存在する可能性もあり,これによってはじめて複数の因子がエレメントに同時に結合して高次の複合体形成が可能になるが,安定化因子そのものは不安定なためにin vitroでは検出できない-という仮説も考えられ,今後の検討を要する。 以上のゲルシフトによってK5complex上に同定された3つの蛋白結合部位が,実際に転写調節にどのように機能しているのかを検討するために,様々なinternal deletion(欠失変異)および各々の部位に点突然変異を起こしたmutantプラスミドを作製し,HeLa,SCC-F12,正常ヒト表皮細胞にトランスフェクトしてCATアッセイを行い,それらの転写活性をwild typeのそれと比較した。結果はいずれのdeletionでもmutantでも転写活性が低下し,その程度は前者ではほとんど消失しているが後者では半分程度であり,またその傾向は3種類の細胞いずれにおいても同様であった。このことから,3つの蛋白結合部位は,そのどれか1つでも蛋白と結合できない状況下にしてしまうと転写活性が低下するため,いずれも本来の転写機能の発揮に重要であると考えられるが,複数の点突然変異を起こして各部位を破壊してもなおかなりの活性が保たれる,ということは注目に値する。各部位の相互作用については推測の域を出ないが,1つ機能しなくても残りの2つが不完全ながら機能する可能性や,3つの結合部位と他の遠隔の制御部位とのcis,または他の制御因子とのtransの重要な相互作用が存在する可能性も考えられる。 最後に,他の表皮ケラチン(K6,K14,K16,K17)遺伝子調節領域における3つの部位の関与の可能性について,塩基配列とゲルシフトを用いて検索した結果を付け加えておきたい。即ち,K5で同定された3つの結合部位のモチーフが位置関係の相違こそあれ,多くの表皮ケラチン遺伝子上流域で近接して存在していることが判明したが,このことはこれらケラチン発現の表皮特異性を考えるとき,重要な意味をもっているのかもしれない。細胞特異的転写因子による細胞分化の例としてはMyoDによる筋細胞への分化誘導が発見されているが,ケラチノサイトにおいては未だ特異性の高い制御因子は見出されておらず,むしろ特異性の比較的低い因子でもその組み合わせや,それらに二次的に結合する因子の特異性によって高い細胞特異性が生まれることも十分考えられ,今回の結果はそれを示唆するものともいえよう。 ヒト表皮ケラチンの中で,とくに基底細胞において特異的に発現されるK5ケラチン遺伝子上流の調節領域に作用する転写制御蛋白を,DNAトランスフェクションとゲルシフト法を用いて分析した結果,約40bp中に複数の制御蛋白が関与するエレメントを見出した。それらの蛋白は転写因子AP2とSp1の他にいくつかの未同定の核蛋白を含み,それらの蛋白が作用する部位はAP2,Sp1両結合部位,そしてSite Aという隣接する3つから成っており,制御蛋白は各部位においてin vitroでは相互排他的に結合し,各部位はいずれもin vivoでは本来の転写機能を発揮するために重要であると考えられた。さらに,それら3つの部位のクラスターを他のヒト表皮ケラチン遺伝子調節領域中でも検索し,それらの組み合わせがケラチノサイト特異的転写調節に関与する可能性があることが示唆された。細胞特異的な転写調節は臓器の分化,発癌のメカニズムを解く鍵であり,今後さらなる解析が望まれよう。 | |
| 審査要旨 | 本研究は,ケラチン遺伝子の発現制御に関わる転写因子のネットワークを明らかにするため,ヒト表皮ケラチンの中で基底細胞において特異的に発現されるK5ケラチン遺伝子上流の調節領域に作用する転写制御蛋白を,DNAトランスフェクションとゲルシフト法を用いて分析したものである。筆者はK5ケラチン遺伝子上流域(約900bp)を検討することにより,preliminaryに複数の核蛋白結合部位を同定したが,そのうち最も下流の部位のすぐ近傍に塩基配列上AP2認識部位が同定され,その両者を含んだ約40bpのエレメントは,転写活性に極めて重要であることがトランスフェクション・アッセイにより示された。表皮細胞特異的な転写制御因子の候補として近年報告されたKER1,KTP-1はともにAP2との関連が示唆されているため,この比較的短い領域に結合して転写制御に関わる核蛋白の機能,独自性と相互作用について検討を試みたのが本研究の内容であり,下記の結果を得ている。 1.筆者が焦点を当てた約40bpのエレメント(K5-203/-166;K5complexと呼ぶ)をプローブとし,種々の既知の転写因子結合部位のコンセンサス配列を有するオリゴヌクレオチドをコンペティターとして,HeLa細胞および正常ヒト表皮細胞から抽出した核蛋白を用いてゲルシフトを施行したところ,AP2とSp1オリゴはそれぞれコンペティションにより相異なるバンドを消失せしめ,さらにSp1-specific antibodyを用いたスーパーシフトを施行することにより,K5complexには転写因子AP2とSp1が個別に結合することが示された。その塩基配列中にはSp1のコンセンサス配列は存在しないが,AP2部位のすぐ下流にGCCCAGCCCAというGC-richな領域があり,ゲルシフトを繰り返してK5Sp1結合部位をそこに同定した。 2.ケラチンK16の遺伝子調節領域中に存在するSp1結合部位(コンセンサス配列)をプローブとしてK5Sp1結合部位と比較してみたところ,スーパーシフトにおいて両者は全く同一のパターンを呈し(同部位には転写因子Sp1以外にも別の核蛋白が結合することが示された),しかも相互にコンペティションが認められた。この事実は,相異なるケラチン遺伝子の発現に共通の制御因子がしかも複数のグループとして関与するということを裏付ける意味で,初めての報告といえる。 3.K5complex中のSp1,さらにAP2の箇所にも変異を作ったものをプローブとしてゲルシフドを行ってみると,新たなバンドが認められた(Site Aへの結合)。Site AはAP2とSp1結合部位のすぐ下流に隣接する形で位置し,K5complex中に新たな制御因子が結合してAP2,Sp1とin vivoにおいてクラスターを作る可能性が示唆された。即ち,蛋白は各々の部位においてin vitroでは相互排他的に結合するが,in vivoにおいてはエレメントに結合した制御因子にさらに作用する未知の安定化因子が存在する可能性も考えられる。 4.internal deletionおよび各部位に点突然変異を起こしたmutantプラスミドを作製し,HeLa,有棘細胞癌,正常ヒト表皮各細胞にトランスフェクトした後CATアッセイを行って転写活性を測定した結果,3つの蛋白結合部位はいずれも本来の転写機能を発揮するために重要と考えられた。 5.以上,K5で同定された3つの部位のクラスターを他のヒト表皮ケラチン(K6・K14・K16・K17)遺伝子調節領域中でも検索した結果,それらの組み合わせがケラチノサイト特異的転写調節に関与する可能性があることが示唆された。 以上,本論文はケラチン遺伝子発現制御に関わる転写因子のネットワークの解明に重要な貢献をなすと考えられ,また表皮の分化・発癌のメカニズムを解く鍵ともいえる表皮細胞特異的な転写調節に関しても1つの可能性を提起したという意味で,学位の授与に値するものと考えられる。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/53982 |