Contact inhibition theoryは培養正常細胞が高密度培養条件下で接触すると増殖を停止することから細胞接触による増殖抑制機構が存在すると想定された仮説である。この仮説の生体内における意義は、細胞の過剰増殖が抑制されることによって臓器恒常性が維持される点にあると推定されているが、その機序については殆どが不明である。 筆者の研究は共同研究者の藤原らが接触阻止現象の生体内における意義を肝再生過程において検討したことに端を発する。藤原らは、培養肝細胞を用いて肝細胞膜(ratliver plasma membrane:以下PM)による増殖抑制の作用はS期から6時間以前のG1期に見られたと報告している。筆者の研究はこの作用機序を解明することから、肝細胞のG1期早期増殖機構を知ることを目的に開始された。 従来、肝細胞増殖に関する研究ではラットなど小動物から単離した初代培養肝細胞が汎用されてきた。しかし、この細胞は特に増殖の点で他の細胞とは異なる特殊な細胞系と考えられている。即ち、初代培養肝細胞は単離直後は殆ど増殖能がない。十分なDNA合成を生じさせるためには、一定時間予備培養した上で増殖因子を添加し、実験を開始する。通常、この時間として24時間程度が汎用されるが、この理由は不明であった。細胞単離に際して用いられるコラゲナーゼによる細胞障害からの回復に要する時間とする考えが一般的であったが、明らかな証拠はなかった。筆者は細胞単離により生体内の細胞接触を解除された静止期(G0期)の肝細胞が、何らかの原因によりコンピテント状態、即ち増殖因子へ反応しうる状態に達するのに要する時間であり、肝細胞膜はこの過程を抑制するものと想定した。コンピテント状態をきたす要因として、他の細胞系でそのような作用を有するとされているprotein kinase C.Aなどの細胞内情報伝達系の関与に注目し、以下の検討を行なった。 ラット初代培養肝細胞の培養24時間目にepidermal growth factor(EGF)とinsulinまたはPKC活性化作用のある12-o-tetradecanoyl-phorbor-13-acetate(以下TPA)を添加し、48時間目のDNA合成を比較したところ、肝細胞のDNA合成はEGFとinsulinによって十分な誘導されたのに対し、TPA添加では無添加の対照と有意差はなかった。EGFとinsulinがS期へのプログレッション作用を有するのに対し、PKCを活性化してもその作用は生じないと考えられた。次に、培養開始直後にラット肝より精製したPM、vasopressin(VP)、TPAを添加し、これらを6または24時間目に洗浄して除いた後に、EGFとinsulinを添加し、各々24時間後のDNA合成を測定した。EGF及びinsulinを6時間目に添加した際のDNA合成は、これらを24時間目に添加した場合の7%にすぎなかった。一方、VPまたはTPAにより前処置しておくと、このDNA合成は有意に上昇し、24時間目にEGF,insulin添加した場合のDNA合成の30%にまで達した。しかし、この上昇はPMを添加しておくと全く認められなかった。VPまたはTPA添加を培養4から24時間目までとしてもほぼ同様の結果が得られた。PKCを活性化しておくと、培養開始直後においてもEGF,insulinにより著明なDNA合成の誘導が見られたことから、PKCを介する細胞内情報伝達が肝細胞のコンピテント状態への移行を促進したものと考えられ、PMはこの過程を抑制したと推定された。一方、protein kinase A,Gについても同様の検討を行なったが、PKCのようなコンピテント作用は認められなかった。各種protein kinase inhibitorを用いた実験からも、肝細胞のG1期早期におけるコンピテント状態成立を促進する因子としては、PKCが最も重要な情報伝達系であると考えられた。これらの結果から、細胞接触による肝細胞増殖抑制の機序は、PMに存在する増殖抑制因子がPKC活性化以降の情報伝達を抑制することにより、肝細胞がコンピテント状態に向かうことが阻止され、その結果、細胞は静止期に留まるものと考えられた。 一方筆者はこれらの一連の実験を進めるうちに、ラットPMには培養肝細胞の増殖を促進する因子も含まれることを偶然見出した。発見の端緒となったのは、PMに存在する増殖抑制因子の細胞周期から見た作用点を知るためにPMの添加を時期を様々に変えてみた実験であった。その結果、PMをG1期中期から後期と考えられる時期に添加すると培養開始直後に添加した場合と逆に、EGF,insulinにより誘導されたDNA合成が有意に増強されることが明らかになった。 このPMに培養肝細胞の増殖促進活性が存在するとの観察は筆者らの報告が初めてである。この活性は熱、酸、各種プロテアーゼ処理で失活、または減弱することより、蛋白性の因子によるものと考えられた。PMは単独ではDNA合成を誘導せず、増殖促進作用は、EGFやhepatocyt’e growth factor(HGF)などのmitogenとの共存により発揮されることから、この因子はcomitogenと考えられた。またこの活性は各種臓器由来の株細胞を用いて検討した結果、肝細胞特異的であることも判明した。本因子はPMを細菌性コラゲナーゼで処理することにより可溶化され、その活性部位は分子量25K以下の分画に含まれるものと考えられた。 肝細胞のcomitogenについては多くの報告があるが細胞膜に存在する因子の報告はない。また、この因子の細胞周期における作用点はG1期の中期または後期に作用すると推定され、同様な作用点を持つ因子の報告は極めて稀であり、細胞増殖の研究においても重要な因子と考えられる。 以上は初代培養肝細胞を用いて、PMに存在する増殖抑制因子及び増殖促進因子について検討した結果である。しかし、両者共に正常のラット肝に存在する生理的因子であるため、これらの生体内における意義が注目される。そこで筆者は、ラットに70%部分肝切除を行ない、術後経時的に摘出した肝よりPMを精製し、増殖促進及び抑制活性の推移を検討した。 PMの増殖促進活性は肝切除術後直後より低下し始め、16時間目には殆ど消失たが、31時間目には正常肝PMと同等の活性に回復した。この結果から、PMの増殖促進因子は生体内においても肝細胞増殖に関連する因子であり、肝再生過程で消費された可能性が示唆された。一方、増殖抑制活性は部分肝切除術後31時間目までほぼ一定であった。この抑制活性が正常肝と70%部分肝切除後12時間目の肝との間に差が無かったことは既に共同研究者の藤原らが報告しているが、筆者の検討はより詳細な経時的推移を観察したものである。PMの増殖抑制活性は肝再生過程では変化せず、藤原らの考察と同様に、この抑制因子活性の変化が肝再生の引き金にはなりえないものと考えられた。 近年、肝細胞の増殖調節機構についてはHGFやtransforming growth factor 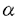 、 、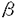 などの液性因子の作用が注目されている。しかし、筆者らは以上の結果を基に、肝細胞膜による肝細胞増殖調節機構が存在するとの仮説を提唱しているので、その概要について言及する。 などの液性因子の作用が注目されている。しかし、筆者らは以上の結果を基に、肝細胞膜による肝細胞増殖調節機構が存在するとの仮説を提唱しているので、その概要について言及する。 血中には多くのコンピテント因子が存在しているが、正常肝の肝細胞は細胞接着が強固で、肝細胞膜中の増殖抑制因子の作用を受けるため、静止期(G0期)に保たれている。しかし、肝障害等により、肝細胞間隙が開大すると肝細胞は肝細胞膜中の増殖抑制因子の作用を免がれ、コンピテント因子によりG1期に移行する。コンピテント状態に到達した肝細胞はHGFなどのmitogenによりS期、更にM期へと進展する。この際、肝細胞膜中の増殖促進因子はmitogenの作用を増強して、肝細胞の増殖を促進する。肝細胞が分裂を終え、細胞接着を回復すると、細胞膜中の増殖抑制因子の作用が再び発現し、静止期に維持される。 これらの肝細胞膜の増殖調節因子を同定し、以上の仮説を証明していくことが今後の課題である。 |