学位論文要旨
| No | 213252 | |
| 著者(漢字) | 長田,俊治 | |
| 著者(英字) | ||
| 著者(カナ) | ナガタ,シュンジ | |
| 標題(和) | 抗α-フェトプロテイン抗体とビンカアルカロイドとのコンジュゲイトの抗腫瘍作用 | |
| 標題(洋) | ||
| 報告番号 | 213252 | |
| 報告番号 | 乙13252 | |
| 学位授与日 | 1997.03.12 | |
| 学位種別 | 論文博士 | |
| 学位種類 | 博士(薬学) | |
| 学位記番号 | 第13252号 | |
| 研究科 | ||
| 専攻 | ||
| 論文審査委員 | ||
| 内容要旨 | 抗癌剤の多くは標的とする癌細胞以外に宿主側の正常細胞に作用し、このことが癌の化学療法にとって大きな障壁となっている。抗癌剤を癌細胞に選択的に送達させることにより、少量の抗癌剤で優れた抗腫瘍作用を発揮できるとともに副作用の軽減が可能となる。本研究は、肝細胞癌患者に特異的なα-フェトプロティン(AFP)に対するモノクロナール抗体をキャリヤーとして、上記の目的達成を図ったものである。 ヒト肝細胞癌細胞のHuH-7のin vitro培養液から精製したAFPをBALB/cマウスに免疫し、脾臓中のB細胞とマウスミエローマ細胞NS-1とをPEG4000を用いて細胞融合した。融合後の細胞の選別およびクローニングなどはすべて常法に従って行った。限外希釈法を経て合計12ラインの抗AFPモノクロナール抗体産生ハイブリドーマを得た。抗体の分布は80G抗体(IgG1)を、コンジュゲイトの研究には35G抗体(IgG2a)を用いた。 125I標識した80G抗体を、HuH-7細胞を皮下移植したヌードマウスの尾静脈から投与し、4日後までの全身オートラジオグラムを作製したところ、長時間にわたって腫瘍に放射活性の残存が認められた。さらに、80G抗体と非特異抗体の組織取り込み速度指数を比較したところ、80G抗体では腫瘍への取り込み速度が非特異抗体の約2倍速かった。これらの結果から、80G抗体はAFP産生細胞に対して選択的に分布することが確認された。 Vinblastineを出発原料として、4位の脱アセチルと3位のアジド化を経て、35G抗体のlysine残基と直接化学結合させた(VDS-35G)。35G抗体1モルに結合したvindesine(VDS)のモル数は、3.1モルであった。VDS-35GのAFPに対する結合活性は、元の35G抗体と比して低下はほとんど認められなかった。また、35G抗体単独およびVDS-35Gとも正常ヒト血清およびヒトアルブミンに対しては結合活性を全く示さなかった。 VDS-35Gのin vitroの抗腫瘍作用を単層培養法とコロニー法で評価した。単層培養法では、VDSは50ng/mlの濃度で活性を示したが、VDS-35Gの同一濃度ではコントロールと細胞数が変わらず、活性の消失が懸念された。コロニー法としては、Human Tumor ClonogenicAssay(HTCA)法を用いた。HTCAでは、VDS-35Gは0.5ng/ml以上の濃度でHuH-7細胞に対して抗腫瘍作用を示し、VDSは単層培養法の値とほぼ同じ50ng/ml以上で抗腫瘍作用を示した(図1)。評価方法によるVDS-35Gの抗腫瘍作用の違いは、コロニー形成に寄与しているstem cellで活発にAFPが産生されるため、VDS-35Gが選択的にstem cellに送達したと推定している。以下HTCAを用いて詳細にVDS-35Gの機能を評価した。  35G抗体単独および非特異抗体とのコンジュゲイト(VDS-n-IgG)は、いずれも抗腫瘍作用を示さなかった。また、VDSと35G抗体の非化学結合混合物では抗腫瘍作用の増強が認められなかった。さらに、AFPを産生しないヒト肝細胞癌細胞HuH-13に対しては、VDS-35GおよびVDS-n-IgGとも抗腫瘍作用が認められなかった。これらの結果から、VDS-35GはAFPを産生する細胞に対してのみ抗腫瘍作用を発現しており、VDS-35Gの抗体の部分がHuH-7細胞の膜表面上のAFPを認識し、VDSが抗腫瘍作用を発揮するものと考えられた。 HuH-7細胞と薬剤の接触時間を種々に変えて抗腫瘍作用を評価した結果、安定した作用を示すために要する時間は、VDSの約60分間に対してVDS-35Gでは10分間に短縮され、35G抗体は細胞表面のAFPを速やかに認識することが確認された。また、細胞表面のAFPと溶液中のAFPに対する35G抗体の親和性は異なり、前者は後者の約10倍高かった。その結果、溶液中のAFP濃度が500ng/ml以下では50%以上の35G抗体は細胞表面のAFPと結合することが計算から示された。いっぽう、HTCAで種々の濃度のAFPをVDS-35Gと共存させたところ、AFPが500ng/ml以下の濃度ではVDS-35Gの抗腫瘍作用に影響が認められなく、計算結果とよい一致を示した。 一般的には、コンジュゲイトはendocytosisにより細胞内に取り込まれた後、lysosomeに到達して薬物が遊離すると考えられる。しかし、VDS-35Gをラットの肝臓の酸性ホモジネート液中に添加したが、VDSまたはその類似化合物の遊離は検出されなかった。さらに、lysosome酵素の阻害剤のleupeptinおよびammonium chlorideをHTCAの系に添加したが、VDS-35Gのin vitro抗腫瘍作用に影響は認められなかった。以上から、抗AFPモノクローナル抗体をキャリヤーとするコンジュゲイトは、endocytosisで細胞内に取り込まれた後、endosomeからkysosomeへの経路に乗らないで、少なくとも一部のコンジュゲイトは、細胞質中のtubulinに直接作用しているものと考えられた。 ヌードマウスの背部皮下にHuH-7細胞を移植13-14日後に、VDS-35GまたはVDSをマウスの腹腔内に投与し、推定腫瘍重量およびマウスの体重の増減を計測した。VDS-35Gの抗腫瘍作用はVDSの10分の1の投与量(VDS;1.25mg/kg、VDS-35G;0.125mg/kg)と同等であった。また、その投与量ではVDSは20%以上の体重減少が認められたのに比して、VDS-35Gでは20%以内にとどまった(図2)。 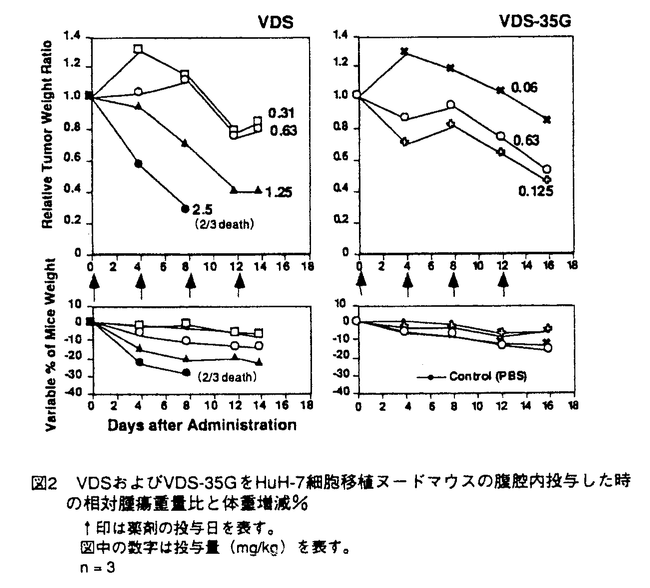 ヒトAFPを認識するモノクロナール抗体とvinca alkaloidとのコンジュゲイトは、in vitroにおいてAFP産生腫瘍への優れた選択的移行性と抗腫瘍作用を示した。その作用機序はlysosome酵素に影響を受けないことが示唆され、トキシン類以外では新しいものと考えられた。さらに、ヌードマウスにおけるin vivo抗腫瘍作用は、VDSの10分の1濃度で効果を示し、副作用の発現も抑制された。以上より、AFPに対するモノクロナール抗体をキャリヤーとしたコンジュゲイトは、肝臓癌の化学療法剤として有望な手段と考えられる。 | |
| 審査要旨 | 抗癌剤を癌細胞に選択的に送達させることにより、少量の抗癌剤で優れた抗腫瘍作用が発揮され、副作用の軽減が可能となりうる。本研究は、肝細胞癌患者に特異的なα-フェトプロテイン(AFP)に対するモノクロナール抗体をキャリヤーとして、動物実験で上記の目的の検証を行ったものである。 ヒト由来のAFPを原料として、細胞融合法により特異性の高い抗AFPモノクロナール抗体(抗AFPMoAb)を得た。AFP産生ヒト肝細胞癌細胞のHuH-7を皮下移植したヌードマウスに125I標識した抗体を投与し、全身オートラジオグラムおよび各組織への取り込み速度指数を測定し、抗体の腫瘍への選択的な分布が確認できた。 Vinblastineを出発原料として、4位の脱アルセチルと3位のアジド化を経て、抗AFPMoAbと化学結合させた(VDS-35G)。抗体1モルに結合したvindesine(VDS)のモル数は、3.1モルであり、AFPに対する結合活性は保持された。 Human Tumor Clonogenic Assay(HTCA)法で抗腫瘍作用を評価した。VDSおよびVDS-35GのHuH-7細胞に対する抗腫瘍作用は、それぞれ50と0.5ng/ml以上であった。抗AFPMoAb単独および非特異抗体とのコンジュゲイト(VDS-n-IgG)は、いずれも抗腫瘍作用を示さなかった。また、VDSと抗AFPMoAbの混合物では抗腫瘍作用の増強が認められなかった。さらに、AFPを産生しないヒト肝細胞癌細胞HuH-13に対しては、VDS-35GおよびVDS-n-IgGとも抗腫瘍作用が認められず、VDS-35Gの抗腫瘍作用はAFP産生腫瘍に特異的であった。細胞表面のAFPに対する抗体の親和性は溶液中のAFPに対するよりも約10倍高いため、溶液中のAFP濃度が500ng/ml以下では、VDS-35Gの抗腫瘍作用は影響されないことが、計算およびHTCAの実測から示された。 Lysosome酵素の阻害剤のleupeptinおよびammonium chlorideをHTCAの系に種々の濃度添加したが、VDS-35Gのin vitro抵腫瘍作用に影響は認められなかったし、VDS-35Gをラットの肝臓の酸性ホモジネート液中に添加したが、VDSまたはその類似化合物の遊離はHPLCで検出されなかった。先のVDS-35Gの特異的な抗腫瘍作用と合わせ考えると、抗AFPモノクローナル抗体をキャリヤーとするコンジュゲイトは、endocytosisで細胞内に取り組まれた後lysosomeへの経路に乗らないと考えられた。 in vivoの抗腫瘍作用について、ヌードマウスの背部皮下にHuH-7細胞を移植13-14後に、VDS-35GまたはVDSをマウスの腹腔内に4日間隔で4回投与し、推定腫瘍重量および体重の増減を計測した。VDS-35Gの抗腫瘍作用はVDSの10分の1の投与量(VDS;1.25mg/kg、VDS-35G;0.125mg/kg)でVDSと同等であった。その投与量では体重減少が、VDS-35Gでは軽微であった。 以上、ヒトAFPを認識するモノクロナール抗体とvinca alkaloidとのコンジュゲイトは、in vitroにおいてAFP産生腫瘍への優れた選択的移行性と抗腫瘍作用を示した。ヌードマウスにおける抗腫瘍作用は、VDSの1/10濃度で効果を示し、副作用の発現も抑制された。これまでにも、種々の抗がん剤-コンジュゲイトのこころみがなされており、本研究もその一つではあるが、動物での抗腫瘍性が確められており、また、AFPに対するモノクロナール抗体をキャリヤーとしたコンジュゲイトは、抗腫瘍作用がlysosome酵素の影響を受けない特長などを明らかにしており、肝臓癌の化学療法剤として有望な手段と考えられる。よって、長田俊治の本研究は医薬化学に寄与するものであり、博士(薬学)の学位を与えることができると判断される。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/51035 |