| 緒言 アレルギー反応のうちI型アレルギー反応はIgE抗体を介した免疫反応であり、抗原曝露後1時間以内に消失する即時相と、5〜8時間後に出現する遅発相の二相性反応のあることが知られている。遅発相の組織像は、好酸球、好塩基球などのアレルギー性炎症細胞の炎症局所への集積をその特徴とし、炎症細胞は様々なメディエーターを遊離してアレルギー性炎症の病態形成に関与している。 一方、炎症局所においては種々のサイトカインの増加が認められ、アレルギー性炎症にサイトカインの果たす役割も明らかになってきた。サイトカインはIgE産生を調節すると共に炎症細胞の炎症局所への動員や、様々な生物学的機能の調節も担っている。また、サイトカインの中でも白血球の走化性能を持つケモカイン(chemotactic cytokine)もin vitroで好酸球、好塩基球に作用することが知られており、また生体内においてもケモカインがこれらの細胞の遊走、活性化に深く関与している可能性が示唆されている。 局所のサイトカイン産生細胞として、従来よりCD4+ヘルパーT細胞、マクロファージ、上皮細胞等が知られていたが、近年、好酸球自身にサイトカイン産生能があることが判明し好酸球がautocrine/paracrineの機序をもってアレルギー性炎症を統御している可能性が示された。好酸球はアレルギー性炎症局所に最も早期に出現する細胞であり、また最も著明な浸潤細胞であるため、好酸球の産生するサイトカインは量的に局所のサイトカインの重要な部分を占めるとともに、アレルギー性炎症の遷延化、重症化に関与していると考えられる。好酸球が産生しうるサイトカインは多種に及んでいるが、その機構、特に産生を誘導する生理的な刺激については殆ど知られていない。 好酸球サイトカイン産生を誘導する生理的な刺激を明らかにする目的で、アレルギー性炎症の局所で形成されると考えられる種々の走化性因子の作用を、ケモカインであるIL(interleukin)-8、MCP(monocyte chemotactic protein)-1産生を主要なパラメーターとして、蛋白level、message levelで種々の走化性因子を用い検討した。さらに、好酸球選択的な活性化因子であるIL-5、及びアレルギー性炎症に強力な抗炎症作用を示すgulucocorticoid(GCC)の影響についても検討を加えた。  図1 走化性因子刺激による好酸球IL-8産生好酸球は、健常人末血より、Percoll密度遠沈法及びmagnet-activated cell sorter(MACS)と抗CD16beadsを用いたnegative selectionを併用して純度95%以上に精製した。96穴平底プレートを用い、精製好酸球(1-4×105/200 図1 走化性因子刺激による好酸球IL-8産生好酸球は、健常人末血より、Percoll密度遠沈法及びmagnet-activated cell sorter(MACS)と抗CD16beadsを用いたnegative selectionを併用して純度95%以上に精製した。96穴平底プレートを用い、精製好酸球(1-4×105/200 l)をcytochalasin B(CB、5 l)をcytochalasin B(CB、5 g/ml)の非存在下(open symbols)、存在下(closed symbols)にて各種濃度のC5a(●、n=7、○、n=4)、FMLP(■、n=6、□、n=4)、PAF(▲、n=7、△、n=5)で37℃、5%CO2の条件下18時間刺激した。培養終了後上清を回収し、IL-8蛋白をELISAにて測定した。好酸球は無刺激下においてもわずかにIL-8を産生したが、図中には無刺激下18時間培養後のCB非存在下、存在下のIL-8産生量(38.7±19.6、154.8±21.2pg/106)を減じて表示した。走化性因子によるケモカイン産生 g/ml)の非存在下(open symbols)、存在下(closed symbols)にて各種濃度のC5a(●、n=7、○、n=4)、FMLP(■、n=6、□、n=4)、PAF(▲、n=7、△、n=5)で37℃、5%CO2の条件下18時間刺激した。培養終了後上清を回収し、IL-8蛋白をELISAにて測定した。好酸球は無刺激下においてもわずかにIL-8を産生したが、図中には無刺激下18時間培養後のCB非存在下、存在下のIL-8産生量(38.7±19.6、154.8±21.2pg/106)を減じて表示した。走化性因子によるケモカイン産生 健常人末梢血からPercoll密度遠沈と抗CD16によるnegative selectionを併用し好酸球を純度95%以上に精製した。好酸球を走化性因子である補体成分由来のC5a、細菌由来のFMLP、脂質メディエーターのplatelet activating factor(PAF)で刺激し18時間培養後、上清中のIL-8蛋白をELISAで測定したが、上清中には無刺激下のそれに比べIL-8の有意な増加は認められなかった。走化性因子による好酸球脱顆粒にはcytochalasin B(CB)の前処理が必須であることが示されている。5分間CBで処理した好酸球を、走化性因子で刺激したところ、C5a、FMLPは濃度依存的にIL-8産生を誘導し、C5aはFMLPに比べ濃度的に約100倍強力であった(図1).個々の好酸球におけるIL-8蛋白の発現は免疫組織染色にて確認された。一方、PAFは有意なIL-8産生を誘導しなかった。また、C-C chemokineであるRANTES、MIP-1aは好酸球の遊走や活性化を惹起することが知られているが、これらもIL-8産生を誘導しなかった。 走化性因子による好酸球IL-8産生のtime kineticsを検討したところ、上清中には3時間後IL-8蛋白が認められ、6時間以後ゆるやかな上昇が42時間後まで観察された。cell associated IL-8も上清とほぼ同様のkineticsを示し量的にも上清中と同程度であった。 また、走化性因子によるIL-8産生の誘導はRNA polymerase IIの阻害剤であるactinomycin Dにより完全に抑制され、mRNAの転写が必須であると考えられた。また好酸球のIL-8mRNAの発現はin situ hybridizationによりsngle cell levelで確認された。 走化性因子刺激はIL-8以外のケモカイン産生も誘導した。同様の系を用いてMCP-1産生を検討したところ、C5a、FMLPは好酸球よりCB存在下で濃度依存的にMCP-1産生を誘導した。 好酸球ケモカイン産生に及ぼすIL-5の影響 IL-5は好酸球選択的な増殖因子であるとともに活性化因子でもあり、生存延長、メディエーターの遊離増強等の作用があることが知られており、in vivoにおいてもアレルギー性炎症局所の好酸球はIL-5により活性化を受けていることが数多く報告されている。 IL-5自体はCB存在下、非存在下にかかわらずIL-8産生をほとんど誘導しなかった。しかしながら、IL-5で好酸球を短時間前処理することにより、C5a刺激によるIL-8産生は顕著に増強された(図2)。  図2 IL-5による好酸球IL-8産生の増強好酸球をIL-5(10nM)で37℃にて30分間処理した後、CB(5 図2 IL-5による好酸球IL-8産生の増強好酸球をIL-5(10nM)で37℃にて30分間処理した後、CB(5 g/ml)存在下、非存在下に走化性因子で刺激した。18時間後、上清中(open column)及びcell lysate中(hatched column)のIL-8蛋白をELISAにて測定した(n=8)。 g/ml)存在下、非存在下に走化性因子で刺激した。18時間後、上清中(open column)及びcell lysate中(hatched column)のIL-8蛋白をELISAにて測定した(n=8)。 IL-5及びその受容体の -chainが共通であるIL-3について、IL-8産生増強の濃度依存性を検討したところ、IL-5、IL-3ともほぼ同じ濃度依存的増強を示し、そのED50は約30pMであった。 -chainが共通であるIL-3について、IL-8産生増強の濃度依存性を検討したところ、IL-5、IL-3ともほぼ同じ濃度依存的増強を示し、そのED50は約30pMであった。 好酸球は末梢血中に少数(200/ l)しか存在せず、また、強いRNase活性のためNorthern hybridizationは不適当であるとされてきた。そこで、mutant probeを用いたcompetitive RT-PCRとhybridization法のプレート上への応用によるmRNAの定量法を確立し、IL-5によるIL-8mRNAの発現に及ぼす影響を検討した。IL-5単独ではわずかなIL-8mRNA発現が確認されたのみであった。C5a刺激により1時間後にはmRNAの発現が認められ、6時間後まで急激な増加が観察された。IL-5で処理することにより、IL-8mRNAの更なる増加が認められた。 l)しか存在せず、また、強いRNase活性のためNorthern hybridizationは不適当であるとされてきた。そこで、mutant probeを用いたcompetitive RT-PCRとhybridization法のプレート上への応用によるmRNAの定量法を確立し、IL-5によるIL-8mRNAの発現に及ぼす影響を検討した。IL-5単独ではわずかなIL-8mRNA発現が確認されたのみであった。C5a刺激により1時間後にはmRNAの発現が認められ、6時間後まで急激な増加が観察された。IL-5で処理することにより、IL-8mRNAの更なる増加が認められた。 好酸球ケモカイン産生に及ぼすGCCの影響 GCCは強力な抗炎症作用を持ち種々の細胞のサイトカイン産生を抑制することが知られている。GCCをin vivoで投与すると、好酸球性炎症を抑え、喘息症状を改善することが知られているが、好酸球サイトカイン産生に及ぼす影響は不明であった。 C5a、FMLP、ionomycin刺激による好酸球IL-8産生はdexamethasone(DEX)により濃度依存的に抑制され、そのID50は刺激の種類にかかわらず10-9Mから10-8Mに認められた。またMCP-1産生もIL-8と同様にDEXにより濃度依存的に抑制された(図3)。 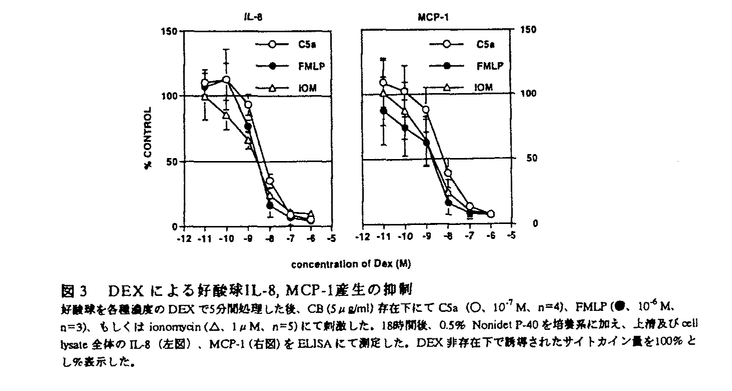 図3 DEXによる好酸球IL-8,MCP-1産生の抑制好酸球を各種濃度のDEXで5分間処理した後、CB(5 図3 DEXによる好酸球IL-8,MCP-1産生の抑制好酸球を各種濃度のDEXで5分間処理した後、CB(5 g/ml)存在下にてC5a(○、10-7M、n=4)、FMLP(●、10-6M、n=3)、もしくはionomycin(△、1 g/ml)存在下にてC5a(○、10-7M、n=4)、FMLP(●、10-6M、n=3)、もしくはionomycin(△、1 M、n=5)にて刺激した。18時間後、0.5%Nonidet P-40を培養系に加え、上清及びcell lysate全体のIL-8(左図)、MCP-1(右図)をELISAにて測定した。DEX非存在下で誘導されたサイトカイン量を100%とし%表示した。 M、n=5)にて刺激した。18時間後、0.5%Nonidet P-40を培養系に加え、上清及びcell lysate全体のIL-8(左図)、MCP-1(右図)をELISAにて測定した。DEX非存在下で誘導されたサイトカイン量を100%とし%表示した。 この作用がGCC特異的であるのかを調べるためにC5aによるケモカイン産生抑制を、種々のsteroidについて検討したところ、methylpredonisolone(MP)、hydrocortisone(HC)はIL-8、MCP-1産生を濃度依存的に抑制し、そのID50はDEX>MP>HCの順であった。一方、sex steroidであるtestosterone、estradiol、progesteroneは何ら抑制を及ぼさなかった。 IL-5は、in vitroにおいてGCCにより誘導される好酸球apoptosisに拮抗することがすでに報告されているが、GCCの好酸球ケモカイン産生抑制もまたIL-5により拮抗されるかを検討した。IL-5にて増強されたchemokine産生は、IL-5未処理のそれと同様にDEXで抑制され、IL-5にはGCCの拮抗作用は認められなかった。 message levelでDEXの抑制効果を検討した。IL-8についてはcompetitive PCR-ELISAにて定量し、MCP-1は内部標準物質を用いたsemi-quantitative PCR-ELISAにて検討した。C5a、ionomycinによるIL-8、MCP-1mRNAの発現は、DEXにより濃度依存的に抑制され、DEXはpre-translationalに作用していると考えられた(図4)。  図4 DEXによる好酸球ケモカインmRNA発現の抑制99.5%以上に精製した好酸球を各種濃度のDEXで5分間処理した後、CB(5 図4 DEXによる好酸球ケモカインmRNA発現の抑制99.5%以上に精製した好酸球を各種濃度のDEXで5分間処理した後、CB(5 g/ml)存在下C5a(10-7M、n=4)、またはionomycin(1 g/ml)存在下C5a(10-7M、n=4)、またはionomycin(1 M、n=3)で刺激した。IL-8mRNAはcompetitive RT-PCRにて定量した。MCP-1mRNAは、cDNAをtemplateとし、MCP-1及び内部標準物質としてハウスキーピング遺伝子である M、n=3)で刺激した。IL-8mRNAはcompetitive RT-PCRにて定量した。MCP-1mRNAは、cDNAをtemplateとし、MCP-1及び内部標準物質としてハウスキーピング遺伝子である -actinに対するプライマーを用いてPCRを行った。PCR-ELISAを行い、 -actinに対するプライマーを用いてPCRを行った。PCR-ELISAを行い、 -actinに対するMCP-1の比を算出し、MCP-1mRNA量を半定量した。DEX非存在下でC5a刺激により誘導されたmRNA量を100%とし%表示した。まとめ -actinに対するMCP-1の比を算出し、MCP-1mRNA量を半定量した。DEX非存在下でC5a刺激により誘導されたmRNA量を100%とし%表示した。まとめ 走化性因子は、白血球に作用してその遊走を誘導する他に、細胞を活性化する。好酸球に対してもO2産生や、メディエーター遊離を惹起する。本研究を通じ、アレルギー性炎症局所で形成されると考えられる走化性因子、特にC5aが好酸球よりケモカイン産生を誘導しうることが示された。走化性因子による産生誘導にはCBによる前処理が必須であった。 アレルギー性炎症局所の好酸球は好酸球選択的な活性化因子であるIL-5により生体内で刺激された状態にあると考えられている。IL-5それ自体はIL-8産生をほとんど誘導しなかったが、C5aによるIL-8産生を増強することが判明した。また、IL-5のpriming効果はtranslation以前の段階で調節されていると考えられた。 アレルギー性炎症の治療薬として頻用されているGCCは種々の細胞のサイトカイン産生を抑制することが知られているが、好酸球に対しては不明であった。本研究によりDEXが生理的な濃度で走化性因子による好酸球ケモカイン産生をmessage level、蛋白levelで抑制することが示された。MP、HCにも抑制作用を認めたがsex steroidは何ら抑制せず、GCC特異的作用であると考えられ、臨床的に重要とされる好酸球を主体としたアレルギー性炎症の遅発相に有効な抗炎症効果を示すものと考えられた。 |