学位論文要旨
| No | 213343 | |
| 著者(漢字) | 野入,英世 | |
| 著者(英字) | ||
| 著者(カナ) | ノイリ,エイセイ | |
| 標題(和) | 誘導型一酸化窒素合成酵素(iNOS)をターゲットとしたアンチセンス療法のラット虚血性急性腎不全モデルに対する効果 | |
| 標題(洋) | ||
| 報告番号 | 213343 | |
| 報告番号 | 乙13343 | |
| 学位授与日 | 1997.04.25 | |
| 学位種別 | 論文博士 | |
| 学位種類 | 博士(医学) | |
| 学位記番号 | 第13343号 | |
| 研究科 | ||
| 専攻 | ||
| 論文審査委員 | ||
| 内容要旨 | 急性腎不全は、急激な糸球体濾過率の低下をもたらす病態を総称した症候群である。虚血性急性腎不全は、腎前性虚血とその後の再灌流により生じるpatchy and segmentalな壊死性ネフロンを特徴としているが、Litten Mが犬、兎で1.5〜2時間腎動脈を一時的に阻血すると尿細管壊死を生ずるモデルとして発表して以来、急性腎不全モデルの中で最も研究されてきたモデルの一つである1.。現在では、このモデルでの尿細管壊死は、虚血再灌流によって腎臓にもたらされたオキシダントによるものであると考えられている。即ち、虚血下では、細胞内に蓄積されたATPの消費により、これが代謝されてプリン代謝産物を細胞内に蓄積する。また、近位尿細管は、腎臓の中では最もミトコンドリアの多い部位であるが、ミトコンドリアは虚血により電子伝達系の中間代謝産物が還元作用を受け、自由電子を多量に発生する。更に、虚血によってCa2+ ATPasesの活性化が低下するため細胞内Ca濃度は上昇する傾向となる。その上Na-K-ATPaseの再分極により機能低下を生じるため、細胞内外のNaの濃度勾配は低下し、Na-Ca exchangerの作用により細胞内Caを上昇させるメカニズムが働き、細胞内Ca2+の上昇はミトコンドリア膨化作用も引き起こすが、Ca2+依存性proteasesやphospholipasesの活性化も引き起こされ、xanthine dehydrogenaseがxanthine oxidaseへと変換されて細胞内に蓄積される。このような条件が揃っているところで、再灌流が生じると、xanthine oxidaseはプリン代謝産物由来のhypoxanthineを酸化する際に、自由電子を酸素分子へと受け渡すため、図1-(1)のように、活性酸素O2-・を発生する。生理的な条件下では、このようにして発生した活性酸素は、superoxide desmutase(SOD)によって図1-(2)のように過酸化水素として消去され、更に図1-(3)、(4)のように、過酸化水素はcatalaseやGSH peroxidaseにより代謝されてしまう。しかし、虚血再灌流モデルでは、このようにして生じるオキシダントが腎臓に過剰負荷されるため一連の消去系作用が充分でなく、細胞障害作用を引き起こすと考えられる。ここで生じた過剰の過酸化水素はNO産生を誘導し、更に細胞障害を増悪させる。即ち産生されたNOは、すぐにO2-・と反応して図2-(1)のようにperoxynitriteに変換され、更に図2-(2)の反応により2分子のhydroxyradicalを生じる。  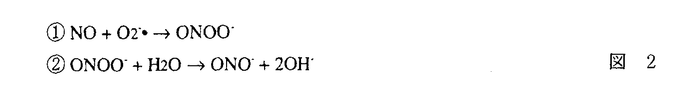 hydroxyradicalは非常に強力なオキシダントで強い細胞障害性を有することは周知の通りである。 以上の反応系に対する治療の試みとしては、PallerらのSOD補充療法が知られているが2、その後の実験では必ずしも一定した効果ではなく、SOD自体のオキシダント中での不安定性や、図2-(1)の反応がSODの消去作用の約3倍早いことが指摘されている。本研究では、虚血再灌流で生じたオキシダントによる細胞障害を、更に押し進める可能性の高い誘導型NO産生の抑制を企図した。In vitroの実験系では、図3-(1)に示したように、過酸化水素によりNO産生は誘導され、iNOSに対するantisense oligodeoxynucleotide(AS)を前投与しておくと、この産生は抑制され、しかも図3-(2)のように、過酸化水素の細胞障害性による細胞死の程度は、antisense oligodeoxynucleotideにより抑制されることが示された。これに対しsense(S)及びscrambled(Scr)では、効果が認められなかった。同様の考察は、SchrierのグループからもHypoxia-reperfusionを、isolated proximal tubulesにかけたモデルで生じる尿細管細胞障害が、誘導型NO由来であり、これがL-NAMEで抑制されることが示された3。 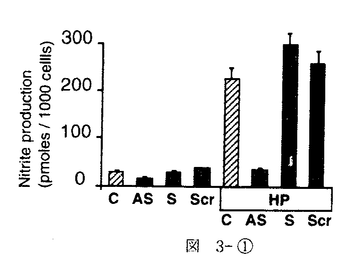 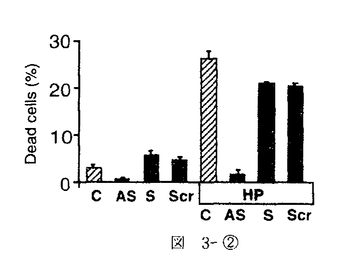 一方in vitroでの観察に反し、急性腎不全におけるNO産生抑制の試みは、既にBrezisらのグループによって行われ、L-NAMEによるNO抑制はむしろ急性腎不全を増悪させてしまうことが、報告されていた4。実際、自験例でも図4のようにL-NAME投与による虚血性急性腎不全の増悪を認めた。このようなin vitroとin vivoの観察の乖離の原因は、腎臓では3種類のNOのtopologyがあるためで、これを無視したやりかたでの非選択的なNO抑制剤の投与はかえって腎障害を悪化させてしまうと推察された。 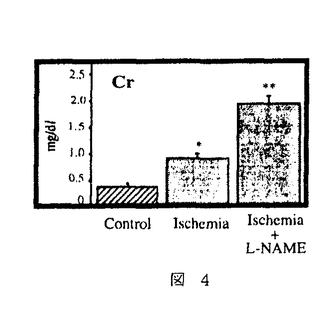 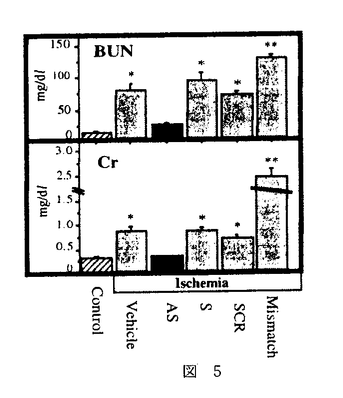 このような問題点を克服するために、in vitroの実験系で効果のあったアンチセンス療法を、ラット虚血性急性腎不全モデルに対して検討した。Antisense oligodeoxynucleotideは、ラット及びマウスのマクロファージ由来の誘導型NOS、ラット腎臓由来の誘導型NOSのcDNAが報告されていたため5、これらにホモロジーが認められたopen-reading frameをターゲットとして作製された。図5に示したように、術後第一日目の血清クレアチニン(Cr)及び血清尿素窒素(BUN)は、無治療の虚血群(Vehicle)、sense投与群(S)、scrambled投与群(SCR)、mismatch投与群で、対照(sham)群(Control)と比較して有意な上昇を認め、これに対して、antisense投与群(AS)では有意な抑制効果を認めた。そこで次に、antisense投与群は組織学的にはどのような改善を認めたかを分析する目的で、SolczらのPathological scoringの基準に基づいて二重盲検法により検討した6。図6に示したように、尿細管壊死、円柱形成、刷子縁消失、尿細管拡張、間質性浮腫の項目での改善をantisense投与群(AS)で認めた。これは誘導型NOSに対するアンチセンス療法が、虚血再灌流により生ずる腎尿細管障害に対して保護作用があることを示したものと考えられた。 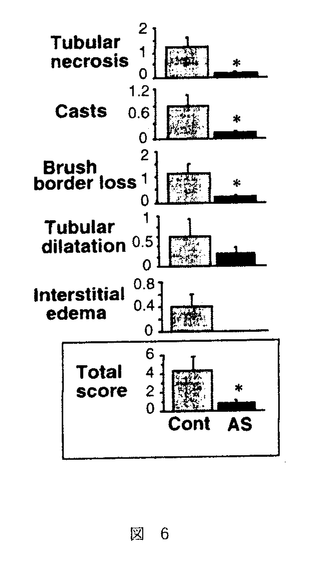 本研究では、虚血再灌流による腎障害が、少なくとも一部はNOによって担われており、そのNOのisoformは誘導型であることを、誘導型NOSに対するantisense oligodeoxynucleotideを用いることにより示した。 更にまた、誘導型NOSに対するアンチセンス療法の虚血性急性腎不全に対する効果は、尿細管レベルでのインターベンション療法であることが組織学的検討より示され、今後その他の急性腎不全モデルでの検討、ひいては臨床治療への応用が期待される。 | |
| 審査要旨 | 本研究は、虚血性急性腎不全モデルや尿細管障害モデルにおいて細胞障害性に関与し重要な役割を演じていると考えられている一酸化窒素(NO)が、従来より誘導型と構成型のどちらに主に由来するかという点で観察に混乱があったのに対し、誘導型一酸化窒素合成酵素(NOS)に対するantisense oligodeoxynucleotideを用いることにより、その解明を試みたものであり、下記の結果を得ている。 1. 誘導型NOSの開始コドンをターゲットにしたantisense oligodeoxynucleotideをヒトcDNAをもとに作製した。このantisense oligodeoxynucleotideは、dose dependentに哺乳類の尿細管細胞由来のBSC-1細胞内へ取り込まれることが確認された。更に、誘導型NO産生を引き起こすLPSや過酸化水素水刺激をBSC-1細胞に与えた所、antisense oligodeoxynucleotideを前処理した群では、NO産生が有意に抑制されることが示された。 2. In vivo用として、Open reading frame内のconserved sequenceをターゲットとし、しかもラット及びマウス、ラット腎特異的な誘導型NOSにホモロジーを有するantisense oligodeoxynucleotide(AS-ODN-ORF)を作製した。このantisense oligodeoxynucleotideは、投与後約8時間までに腎皮質の近位尿細管を中心に細胞内に蓄積することが示された。 3. 虚血性急性腎不全モデルにおいて、非特異的なNO産生阻害剤であるL-NAMEを前投与すると全く治療効果を示さず、むしろ増悪効果があることが示された。一方、AS-ODN-ORFの前投与により著しい腎機能の改善が認められたことより、虚血性急性腎不全では腎臓内のNOの機能局在を考慮したNO産生の抑制が治療としては重要であることが示唆された。 4. 誘導型NOSに対するantisense oligodeoxynucleotideが構成型NOSに対して影響を及ぼしている可能性の有無を検討するために、AS-ODN-ORFを前投与した虚血性急性腎不全モデルで、bradykininにより誘発される構成型NOS由来のNO産生が保存されているかどうかをNO用微小電極を用いて検討した。AS-ODN-ORFを前投与した場合でも、保存されることが示され、ここで用いたAS-ODN-ORFの誘導型NOSに対する選択性が確認された。 5. AS-ODN-ORFの虚血性急性腎不全モデルでの効果を評価する目的で、double blind方式による形態学的評価を行った所、主に腎尿細管細胞壊死を防ぐ点にあることが示された。 以上、本論文は近年臨床及び研究面で応用の盛んなphosphorothioated型antisense oligodeoxynucleotideを用い、臨床的には特に移植腎などで重大な問題となる急性尿細管壊死のモデルである、虚血性急性腎不全での誘導型一酸化窒素(NO)の関与を明確化した点で、本病態の解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/51043 |