エンドセリン-1(ET-1)は21アミノ酸よりなる小ペプチドで、主に血管内皮細胞より産生される。ET-1は血管収縮活性のみでなく、血管平滑筋細胞を含めた多くの種類の細胞に対して増殖因子としても作用し、動脈硬化の病態生理に対する関与も示唆されている。培養内皮細胞においては、動脈硬化形成に寄与していると考えられているTGF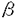 、インターロイキン-1や変性LDLなどによりET-1の発現は亢進することが知られており、さらにヒト動脈硬化病変の平滑筋細胞やマクロファージにおいてもその発現が確認されている。このようなET-1の病態生理学的な役割は実験動物を用いた血管傷害モデルにおいても示唆されている。血管傷害後ET-1やETレセプターの発現は亢進し、ETA/ETB非選択性のレセプター拮抗剤にて肥厚内膜の形成が抑制されることから、ET-1は血管傷害後の肥厚内膜形成に関与していると考えられている。 、インターロイキン-1や変性LDLなどによりET-1の発現は亢進することが知られており、さらにヒト動脈硬化病変の平滑筋細胞やマクロファージにおいてもその発現が確認されている。このようなET-1の病態生理学的な役割は実験動物を用いた血管傷害モデルにおいても示唆されている。血管傷害後ET-1やETレセプターの発現は亢進し、ETA/ETB非選択性のレセプター拮抗剤にて肥厚内膜の形成が抑制されることから、ET-1は血管傷害後の肥厚内膜形成に関与していると考えられている。 ET-1は他のホルモンや神経伝達物質と同様に前駆体のポリペプチドの分解により合成される。まず、その前駆体であるpreproET-1はエンドペプチターゼにより分解されbigET-1となり、さらに分解されET-1が合成される。この最終かつ重要な段階を触媒する酵素がエンドセリン変換酵素-1(ECE-1)である。その活性は中性メタロプロテアーゼ阻害剤であるホスホラミドンにより抑制される。ECE-1の活性の変化はET-1の生合成に対して直接的かつ強力な効果をもたらすと考えられるので、ECE-1はETシステムにおける主要な治療のターゲットとして注目されてきた。最近、ECE-1はラット肺、ブタ大動脈内皮細胞より精製され、NEP24.11やKell blood group proteinとホモロジーを有する膜結合性中性メタロプロテアーゼであることが明らかになった。ECE-1は様々な臓器に分布し、血管内皮細胞に最も強く発現する。 そこで本研究では、ECE-1が血管傷害後の肥厚内膜形成や動脈硬化の病態生理に関与しているかどうか、またさらに、治療のターゲットとなりうるかを明らかにするため、ラット血管傷害モデルとヒト動脈硬化病変におけるECE-1とET-1の発現について検討した。さらに、ECE-1の阻害剤であるホスホラミドンの効果をラット血管傷害モデルを用いて検討した。 ラット血管傷害モデルはClowesらの方法に従って作製した。術後2日、5日、7日、14日目にラットを麻酔下にて屠殺し総頚動脈を摘出した。ET-1遺伝子発現はノーザンプロット法により検討し、ET-1濃度はELISAにより測定した。ECE-1遺伝子発現の検討にはR Nase Protection Assayを用いた。ECE酵素活性は摘出した血管より調整した膜分画にbig ET-1を加え反応後、生成したET-1をELISAにて測定し評価した。一部のラットには冷水浸透により血管内皮細胞を剥離した後同様の操作を行った。また免疫組織染色用の凍結切片は、4%パラホルムアルデヒドによる浸透固定を行った後摘出した血管をさらに同液にて12時間固定し包埋した後作製した。ホスホラミドンの効果を調べるために、ホスホラミドンを術前7日前から術後14日目まで投与し、術後14日目に形成された肥厚内膜をNIHイメージソフトウェアを用いてPBS投与群と比較検討した。 ヒト動脈硬化病変におけるECE-1発現の検討には急性心筋梗塞後2週間を経た患者よりアテレクトミーにて得られたサンプルを用いた。 ECE-1の免疫組織染色には抗ラットECE-1モノクローナル抗体、抗ラット・ヒトECE-1モノクローナル抗体を用いた。また、第8因子、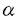 -smooth muscle actin、CD68に対する抗体を用いて、それぞれ内皮細胞、平滑筋細胞、マクロファージを同定した。さらに、抗ET-1抗体によりET-1の局在性をECE-1と比較検討した。 -smooth muscle actin、CD68に対する抗体を用いて、それぞれ内皮細胞、平滑筋細胞、マクロファージを同定した。さらに、抗ET-1抗体によりET-1の局在性をECE-1と比較検討した。 ラット血管傷害モデルにおけるECE-1の遺伝子発現は傷害直後(6時間後、2日目)には一旦減少傾向を示したが、その後増加し14日目には約5倍にまで達した。ECE酵素活性も同様の傾向を示し、傷害後14日目には約2倍の増加を認めた。傷害血管における単位血管長あたりのタンパク重量は非傷害血管に比べ約2倍であったことから、単位血管長あたりのECE酵素活性の増加は血管傷害後3倍以上に達すると考えられた。また、血管傷害後のECE酵素活性の時間経過はECE-1の遺伝子発現の時間経過に似ていることから、ECE酵素活性の変化は遺伝子発現の変化を反映しているものと思われた。 傷害後14日目にはET-1レベルも約2倍に増加していた。これに対して血管傷害後のET-1の遺伝子発現には有意な変化を認めなかった。これらは血管傷害後のET-1レベルの増加がタンパク生合成の段階以降で調節されることを示唆し、ECE-1の発現の増加と合致する結果であると考えられた。 傷害血管、非傷害血管におけるECE-1の発現部位を明らかにするため、冷水浸透による内皮細胞剥離後、ECE酵素活性の測定を行った。非傷害血管においてはPBS処理後と比較して冷水処理後では約55%まで活性の減少を認めたのに対し、傷害血管では有意な変化は認めなかった。この結果は傷害血管におけるECE-1の発現の増加は内皮細胞以外の細胞群に由来することを示唆しているものと思われた。 さらに、ECE-1の局在性を詳細に検討するため、抗ラットECE-1抗体を用いた免疫組織染色を施行した。非傷害血管においてはECE-1は内皮細胞のみにその発現を認めた。傷害後2日目ではECE-1の発現はほとんどみられなかった。傷害後5日目、14日目には、肥厚内膜内にECE-1の発現を認めたが、中膜には認めなかった。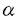 -smooth muscle actinに対する抗体による検討によりECE-1は主に肥厚内膜内の平滑筋細胞に発現していると考えられた。ET-1の発現はECE-1と同様に肥厚内膜内に局在していたことから、傷害血管におけるECE-1の発現の増加は局所のET-1濃度の上昇をもたらし、血管傷害後の肥厚内膜形成に関与している可能性があると思われた。また、内膜、中膜平滑筋細胞におけるECE-1の発現量の相違は平滑筋細胞の表現型の変化を反映している可能性があると考えられた。 -smooth muscle actinに対する抗体による検討によりECE-1は主に肥厚内膜内の平滑筋細胞に発現していると考えられた。ET-1の発現はECE-1と同様に肥厚内膜内に局在していたことから、傷害血管におけるECE-1の発現の増加は局所のET-1濃度の上昇をもたらし、血管傷害後の肥厚内膜形成に関与している可能性があると思われた。また、内膜、中膜平滑筋細胞におけるECE-1の発現量の相違は平滑筋細胞の表現型の変化を反映している可能性があると考えられた。 ECE-1の阻害剤であるホスホラミドンの肥厚内膜形成に対する効果の検討ではホスホラミドンの有効性が示された。ホスホラミドン投与により傷害、非傷害血管ともにET-1レベルは著明に減少し、さらに、ホスホラミドン投与群ではPBS投与群に比べ、中膜の面積には変化を認めないのに対し内膜の面積は有意な減少を認め、内膜/中膜比は約50%の減少を示した。これらの結果はECE-1の肥厚内膜形成に対する関与を強く示唆するものであると思われた。 ヒト動脈硬化病変におけるECE-1の発現を調べるため、アテレクトミーにて得られたサンプルについて免疫染色を行った。ECE-1の発現は主に平滑筋細胞で構成される肥厚内膜内だけでなく、マクロファージの集簇部位にも認めた。ET-1の発現も同様に両領域にみられた。これらの結果はヒト動脈硬化病変においてECE-1を含めたETシステムが同一の細胞群に存在し機能している可能性を示唆した。 本研究はラット血管傷害モデルとヒト冠動脈硬化病変におけるECE-1とET-1の発現を検討したものである。ラット血管傷害モデルは病態生理学的にはヒト動脈硬化とは多くの点で異なるが、平滑筋細胞の内膜形成という点では動脈硬化のいくつかの特徴を共有している。したがって、本研究によりECE-1を含めたETシステムの病態生理学的な役割をより一層明らかにすることができると考えられた。 多くの報告により、ET-1がヒト動脈硬化の病態生理に関与していることが示唆されている。Lermanらは血漿中のET-1レベルは動脈硬化の重症度と相関し、その発現は平滑筋細胞に認められると報告している。さらに、ZeiherらはET-1が平滑筋細胞だけでなくマクロファージにも発現し、その発現は活動性の高い冠動脈硬化病変において有意に増加していると報告している。さらに、多くの報告はECE-1が組織、血漿中のET-1レベルを調節していることを示唆している。本研究においては、血管傷害後ECE-1の遺伝子発現や酵素活性はともに増加し、その発現は肥厚内膜に認められた。ET-1レベルも同様に血管傷害後増加し、その発現は肥厚内膜に認められたが遺伝子発現には変化がみられなかった。ECE-1の阻害剤の投与は血管傷害後の肥厚内膜形成を抑制した。ヒト動脈硬化病変においても有意なECE-1の発現を認めた。以上より、ECE-1は局所のET-1レベルを調節することによって血管傷害後の肥厚内膜形成や動脈硬化の病態生理に関与していると考えられ、今後治療のターゲットになり得ると思われた。 |