環状ウレア誘導体の1,3-ジメチル-2-イミダゾリジノン(1)、1,3-ジメチル-3,4,5,6-テトラヒドロ-2(1H)-ピリミジノン(2)は、双極子非プロトン性溶媒として知られている。1982年Seebach等により2は、発ガン性物質の可能性が指摘されるヘキサメチルリン酸トリアミド(3)の代替品として推奨された。以来とりわけ有機金属化学の分野においては、添加剤として、あるいは混合溶媒として用いられている。 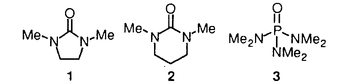 一方カルボニル化合物をLDA等の塩基で処理して生成されるリチウムエノラートとアルキル化剤との反応は、炭素-炭素結合形成反応の中で、重要かつ基本的な反応の一つである。このリチウムエノラートとアルキル化剤の反応を、2が加速することもSeebach等により報告されている。よってキラルな環状ウレア誘導体をこの反応系に添加すれば、反応を加速すると共に、エナンチオ選択的な不斉反応が進行する可能性があると考え本研究に着手した。 そこでキラルな環状ウレア誘導体をデザイン・合成し検討した結果、1-テトラロン(4)の不斉アルキル化反応に有効な環状ウレア誘導体を見出すことができた。 (1)キラルウレア誘導体を用いた1-テトラロン(4)の不斉アルキル化反応 ウレア誘導体(1,2)によるリチウムエノラートのアルキル化反応の加速は、ウレア誘導体のカルボニル酸素がリチウムエノラートのリチウムに配位することによって起こると考えられるため、この酸素の近傍に不斉空間を構築するためのデザインを行った。合成したLigand6は、X線結晶構造解析によりデザインの段階で予想されたとおりの立体配座を有していることが確認された。これらC2対称性キラルウレアLigandを用い、1-テトラロン(4)の不斉メチル化反応に対する効果を検討した結果をTable1に示した。 窒素の側鎖にネオペンチル基を有するLigand6を用いると、収率13%・不斉収率45%eeでS体を与えた(run4)。側鎖に立体的に嵩高い置換基を導入すると、収率が低下し反応の加速性が減少する傾向が見られた。五員環上窒素の側鎖に不斉炭素を有するLigand10の場合には、収率30%とLigandを用いない場合よりも約3倍向上した(run11)。 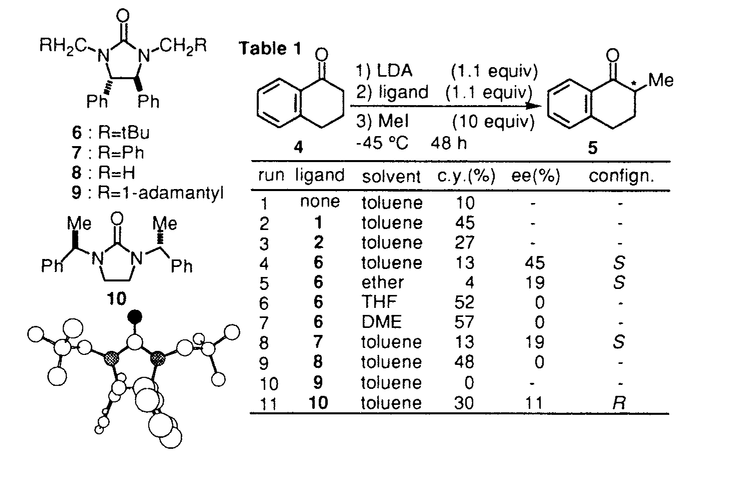 Table 1 Table 1 Ligand6を用いて、反応溶媒・アルキル化剤・基質等の反応条件について検討したが、収率・不斉収率の改善は認められなかった。 種々Ligandを検討した結果から、反応の加速効果が低い原因は、反応の加速および不斉誘起のために有効なリチウムエノラートとLigandの錯体の形成阻害あるいは反応点の遮蔽等にあると考えられ、この要因は、側鎖の立体的に嵩高い置換基によるという可能性が示唆された。 (2)非C2対称性キラルウレア誘導体を用いた不斉メチル化反応 上記環状ウレア誘導体の窒素上にある二つの側鎖のうち一つをメチル基に変換すれば、不斉誘起に悪影響を及ぼすことなく、反応の加速性が向上すると考えLigand11,12,13のデザインを行った。合成した非C2対称性を有するキラルウレア誘導体の、1-テトラロン(4)の不斉メチル化反応に対する効果を検討した結果をTable2に示した。 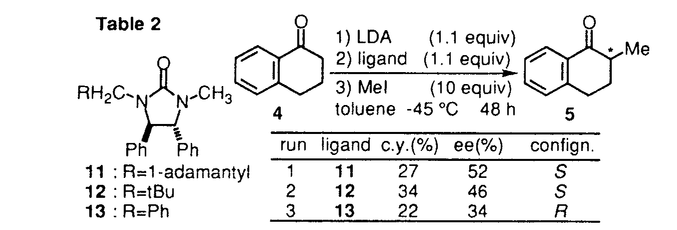 Table 2 Table 2 五員環上窒素の側鎖の一方がメチル基に変換されたLigandを用いた場合、検討した全てにおいてC2対称性キラルウレア誘導体を用いた場合よりも収率は向上した。不斉収率に関しては、Ligand11を用いると52%eeと一番高い値を示した。 非C2対称性キラルウレアLigandを用いた場合では、側鎖の置換基が立体的に嵩高くなればなる程、不斉収率が向上する傾向が見られたが、逆に収率は低下する傾向が見られた。よって収率・不斉収率どちらにも有効なLigandに変換するためには、この非C2対称性キラルウレアLigandの側鎖の置換基を変換するだけでは限界があると予想された。 (3)側鎖に酸素置換基を有するキラルウレア誘導体を用いた不斉アルキル化反応 上記のLigand10は、窒素上の置換基がいずれも -phenethyl基、すなわち -phenethyl基、すなわち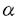 位が分岐した置換基を持つ環状ウレア誘導体である。Table1に示したように、この10の添加によって、メチル化反応は加速され、かつ不斉も誘起されている。またその他の結果から、五員環窒素上のアルキル側鎖への酸素置換基の導入は、反応加速性の向上が確認されたため、容易に入手可能なキラルアミノアルコール類を不斉源としたキラルウレアLigandを種々合成した。これらのLigandの中で14は、反応の加速性および不斉収率に最も効果を示した。 位が分岐した置換基を持つ環状ウレア誘導体である。Table1に示したように、この10の添加によって、メチル化反応は加速され、かつ不斉も誘起されている。またその他の結果から、五員環窒素上のアルキル側鎖への酸素置換基の導入は、反応加速性の向上が確認されたため、容易に入手可能なキラルアミノアルコール類を不斉源としたキラルウレアLigandを種々合成した。これらのLigandの中で14は、反応の加速性および不斉収率に最も効果を示した。 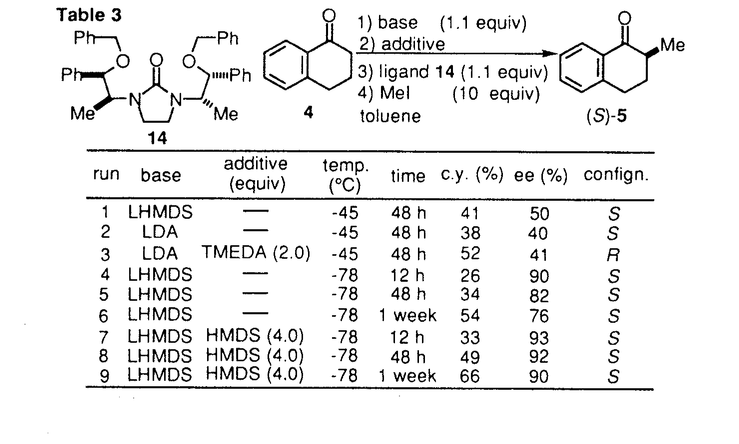 Table 3 Table 3 Ligand14を用いて、反応溶媒・アルキル化剤・塩基・中間点添加剤等の反応条件について検討した結果、溶媒にTolueneを、塩基としてLHMDSを用いた場合、-45℃では最も良い50%eeで不斉メチル化反応が進行した。また添加剤としてTMEDAを加えると、用いた全てのアルキル化剤について興味深い生成物の絶対配置の逆転現象が認められた。またこの生成物の逆転現象は、塩基としてLDAおよびLTMPを用いた場合にも見ることができた。 Ligand14を用いた1-テトラロン(4)の不斉メチル化反応の反応条件の検討において、塩基にLHMDSを用い-78℃で反応時間について検討した。この結果、不斉収率は反応時間の延長に伴い低下する傾向がみられた。これは、反応進行に伴って、系内に生成されるLilによる影響が考えられたため、これをトラップすることとした。このLilのトラップが、既に系内に存在するアミンで可能ならば、不斉収率には悪影響を及ぼさないと考えた。そこで過剰にアミンを添加し反応を行ったところ、時間の延長に伴う低下を抑え90%eeを越える選択性を示した。この結果は、アミンによるLilのトラップの可能性を示唆するものである。またLDAを用いた場合過剰のアミンの影響はほとんどなく、反応時間に関係なく一定の値(-78℃で73%ee前後)を示した。このことは、リチウムエノラートとLigandにジイソプロピルアミンを加えた不斉空間は、生成されるLilによる影響を受けることなく、一定の値の不斉収率を与えるものと推察している。 (4)まとめ 不斉Ligandを用いるエナンチオ選択的不斉アルキル化反応の検討を行い、不斉Ligandとしてのキラルな環状ウレア誘導体14を見い出した。さらに、この14を用いた1-テトラロン(4)の不斉メチル化反応において、穏やかな反応の加速と高い不斉誘起(92%ee)とを同時に達成した。 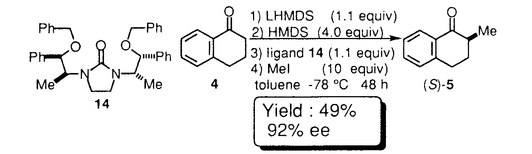 また、同じ14を用いる反応において、アキラルなアミン等を選択して共存させることによって、逆の絶対配置の生成物が得られる例を見出した。 これらの反応機構・不斉誘起のメカニズム等は未だ解明されてはいないが、本研究は、リチウムエノラートに対するウレア横造を有する不斉Ligandの、アルキル化反応における有用性を示した最初の例である。 |