マウスT細胞抗原受容体(T cell receptor:TCR) 鎖遺伝子座は、4個の遺伝子クラスターにより構成されている。このうち 鎖遺伝子座は、4個の遺伝子クラスターにより構成されている。このうち 1クラスターは、4個のV遺伝子と1個のJ遺伝子、1個のC遺伝子からなり、これらは染色体上で5’-V 1クラスターは、4個のV遺伝子と1個のJ遺伝子、1個のC遺伝子からなり、これらは染色体上で5’-V 5-V 5-V 2-V 2-V 4-V 4-V 3-J 3-J 1-C 1-C 1-3’の順に並んでいる。これらのV遺伝子はJ 1-3’の順に並んでいる。これらのV遺伝子はJ 1遺伝子とV-J組み換えを起こすことによりT細胞の多様性を生みだしている。その際、V遺伝子はランダムに使われるのではなく、個体発生の過程で、ある偏りをもって使われることが知られている。 1遺伝子とV-J組み換えを起こすことによりT細胞の多様性を生みだしている。その際、V遺伝子はランダムに使われるのではなく、個体発生の過程で、ある偏りをもって使われることが知られている。  T細胞は胎生14日頃より胸腺内で見られるが、この胎生初期の T細胞は胎生14日頃より胸腺内で見られるが、この胎生初期の  T細胞はV T細胞はV 3TCRを発現している(V 3TCRを発現している(V 3T細胞)。この次に胸腺に出現するのがV 3T細胞)。この次に胸腺に出現するのがV 4T細胞で、これは胎生16日頃より出現し、出生前後に最も多く見られる。V 4T細胞で、これは胎生16日頃より出現し、出生前後に最も多く見られる。V 3、V 3、V 4T細胞は出生後は胸腺内から急速に消失し、成獣胸腺内ではほとんど見られなくなる。一方、V 4T細胞は出生後は胸腺内から急速に消失し、成獣胸腺内ではほとんど見られなくなる。一方、V 2T細胞は胎生後期より出現し、成獣胸腺内では 2T細胞は胎生後期より出現し、成獣胸腺内では  T細胞の大半がV T細胞の大半がV 2T細胞となる。このように 2T細胞となる。このように  T細胞のサブセットは、個体発生の過程でV T細胞のサブセットは、個体発生の過程でV 3→V 3→V 4→V 4→V 2の順番で波状に出現するが、この順番は染色体上でのV遺伝子の配列の順番(J 2の順番で波状に出現するが、この順番は染色体上でのV遺伝子の配列の順番(J 1遺伝子に近い順)と一致している。DNAレベルでみても、V-J組み換えは波状に起きており、この波状組み換えは、細胞表面にTCR 1遺伝子に近い順)と一致している。DNAレベルでみても、V-J組み換えは波状に起きており、この波状組み換えは、細胞表面にTCR の発現がないTCR の発現がないTCR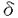 ノックアウトマウスでも認められる。すなわち、V ノックアウトマウスでも認められる。すなわち、V 遺伝子は、J 遺伝子は、J 1遺伝子に近いものから順番に個体発生の過程でV-J組み換えを行うが、これは特定のV 1遺伝子に近いものから順番に個体発生の過程でV-J組み換えを行うが、これは特定のV TCRを発現する細胞が選択されて生き残った結果ではなく、V-J組み換えのレベルで調節された現象であると考えられる。 TCRを発現する細胞が選択されて生き残った結果ではなく、V-J組み換えのレベルで調節された現象であると考えられる。 この発生時期特異的V-J組み換えを説明するモデルとして、競合調節モデルと、自律調節モデルの2つを考案した。競合調節モデルでは、V 遺伝子群の3’側にV-J組み換えを調節する領域を想定する。V-J組み換えの際には、V 遺伝子群の3’側にV-J組み換えを調節する領域を想定する。V-J組み換えの際には、V 遺伝子群の間でこの調節領域を求めての競合が起こり、その結果調節領域により近い、V 遺伝子群の間でこの調節領域を求めての競合が起こり、その結果調節領域により近い、V 3、V 3、V 4がより多く組み換えを起こす(胎児期)。個体発生の過程で何らかの機序によってV 4がより多く組み換えを起こす(胎児期)。個体発生の過程で何らかの機序によってV 3、V 3、V 4が不活化されると、それより遠位のV 4が不活化されると、それより遠位のV 2が組み換えを起こすようになる(成獣期)。一方自律調節モデルでは、組み換え調節領域を各V 2が組み換えを起こすようになる(成獣期)。一方自律調節モデルでは、組み換え調節領域を各V 遺伝子近傍に想定する。この調節領域の特性によって、V 遺伝子近傍に想定する。この調節領域の特性によって、V 3、V 3、V 4遺伝子は胎児期に、V 4遺伝子は胎児期に、V 2遺伝子は成獣期に多く組み換えを起こすように制御されている。 2遺伝子は成獣期に多く組み換えを起こすように制御されている。 どちらのモデルが当てはまるのかを検証するために、染色体上のV 遺伝子の位置を変化させた標的遺伝子組み換えマウスを作成し、そのV-J組み換え様式を解析する計画を立てた。具体的には、V 遺伝子の位置を変化させた標的遺伝子組み換えマウスを作成し、そのV-J組み換え様式を解析する計画を立てた。具体的には、V 4遺伝子とその上流領域を欠失させ、V 4遺伝子とその上流領域を欠失させ、V 2遺伝子をその分ずらすことを考えた。この変異を導入するため、まず通常の標的遺伝子組み換え法によってV 2遺伝子をその分ずらすことを考えた。この変異を導入するため、まず通常の標的遺伝子組み換え法によってV 4遺伝子をネオマイシン耐性遺伝子(neo)カセットで置き換え、次にCre/loxP組み換え系で、この領域をneoカセットともども欠失させるという方法を採用し、この変異マウス(V 4遺伝子をネオマイシン耐性遺伝子(neo)カセットで置き換え、次にCre/loxP組み換え系で、この領域をneoカセットともども欠失させるという方法を採用し、この変異マウス(V 4遺伝子欠失マウス)を作成した。このマウスにおいては、V 4遺伝子欠失マウス)を作成した。このマウスにおいては、V 2遺伝子が、本来V 2遺伝子が、本来V 4遺伝子の存在していた位置にずれてきている。もし、競合調節モデルが正しいとすれば、この変異によりV 4遺伝子の存在していた位置にずれてきている。もし、競合調節モデルが正しいとすれば、この変異によりV 2遺伝子は胎児期〜新生児期に多く組み換えを起こすように変化するはずであり、一方自律調節モデルが正しいとすれば、V 2遺伝子は胎児期〜新生児期に多く組み換えを起こすように変化するはずであり、一方自律調節モデルが正しいとすれば、V 2-J 2-J 1組み換えの時期は変化せず、成獣期に多く組み換えを起こすことが期待される。 1組み換えの時期は変化せず、成獣期に多く組み換えを起こすことが期待される。 まず、マウスゲノムDNAライブラリーをスクリーニングし、TCR 1遺伝子座をクローニングした。このうちV 1遺伝子座をクローニングした。このうちV 2遺伝子の上流からV 2遺伝子の上流からV 3遺伝子の下流までの、約15kbの領域について、以下の変異を導入した。V 3遺伝子の下流までの、約15kbの領域について、以下の変異を導入した。V 4遺伝子の代わりにneoカセットを挿入し、さらにすぐその3’側とV 4遺伝子の代わりにneoカセットを挿入し、さらにすぐその3’側とV 2遺伝子の3’側にひとつずつloxP配列を同じ向きに挿入した。この変異遺伝子の3’末端にチミジンキナーゼカセットをつなぎ、これをプラスミドに組み入れたものをターゲティングコンストラクトとした。このコンストラクトをマウス胚性幹細胞(ES細胞)に導入し、サザン法にて標的遺伝子組み換えを起こしたクローンを同定した。このESクローンをC57BL/6マウスの胚盤胞に注入し、キメラマウスを得た。雄のキメラマウスと雌のC57BL/6マウスを交配して受精卵を回収し、Cre酵素発現プラスミドを前核に注入した。この操作により、受精卵内で発現したCre酵素がloxPで挟まれた領域を欠失させる反応を起こすことが期待された。操作された受精卵132個を偽妊娠マウスの卵管に移植し、11匹の仔を得た。このうち3匹に変異遺伝子が伝わっており、3匹ともCre酵素による欠失反応が起きていた。片方の染色体でV 2遺伝子の3’側にひとつずつloxP配列を同じ向きに挿入した。この変異遺伝子の3’末端にチミジンキナーゼカセットをつなぎ、これをプラスミドに組み入れたものをターゲティングコンストラクトとした。このコンストラクトをマウス胚性幹細胞(ES細胞)に導入し、サザン法にて標的遺伝子組み換えを起こしたクローンを同定した。このESクローンをC57BL/6マウスの胚盤胞に注入し、キメラマウスを得た。雄のキメラマウスと雌のC57BL/6マウスを交配して受精卵を回収し、Cre酵素発現プラスミドを前核に注入した。この操作により、受精卵内で発現したCre酵素がloxPで挟まれた領域を欠失させる反応を起こすことが期待された。操作された受精卵132個を偽妊娠マウスの卵管に移植し、11匹の仔を得た。このうち3匹に変異遺伝子が伝わっており、3匹ともCre酵素による欠失反応が起きていた。片方の染色体でV 4遺伝子が欠失したヘテロマウスどうしを交配し、V 4遺伝子が欠失したヘテロマウスどうしを交配し、V 4欠失マウスを得た。 4欠失マウスを得た。 胎児期(胎齢17日)、新生児期、成獣期(4週齢)のV 4欠失マウスおよび野生型マウスの胸腺よりDNAを抽出し、半定量的PCR法で各発生段階におけるV-J組み換えの頻度を調べた。野生型マウスにおいてはこれまでの報告通り、V 4欠失マウスおよび野生型マウスの胸腺よりDNAを抽出し、半定量的PCR法で各発生段階におけるV-J組み換えの頻度を調べた。野生型マウスにおいてはこれまでの報告通り、V 2-J 2-J 1、V 1、V 5-J 5-J 1組み換えは成獣期に多く、V 1組み換えは成獣期に多く、V 3-J 3-J 1、V 1、V 4-J 4-J 1組み換えは胎児期〜新生児期に多く検出された。V 1組み換えは胎児期〜新生児期に多く検出された。V 4欠失マウスにおいても、V 4欠失マウスにおいても、V 2-J 2-J 1、V 1、V 5-J 5-J 1組み換えは成獣期に多く、V 1組み換えは成獣期に多く、V 3-J 3-J 1組み換えは胎児期〜新生児期に多かった(V 1組み換えは胎児期〜新生児期に多かった(V 4-J 4-J 1組み換えは、V 1組み換えは、V 4遺伝子が欠失しているため検出できなかった)。V 4遺伝子が欠失しているため検出できなかった)。V 2-J 2-J 1、V 1、V 3-J 3-J 1組み換えについてPCR解析を繰り返し、その結果を定量すると、胎児期のV 1組み換えについてPCR解析を繰り返し、その結果を定量すると、胎児期のV 3-J 3-J 1組み換えが変異マウスでやや多かった他は、変異マウスと野生型マウスの間で明らかな差は認められなかった。さらに成獣胸腺DNAをHindIIIで切断し、J 1組み換えが変異マウスでやや多かった他は、変異マウスと野生型マウスの間で明らかな差は認められなかった。さらに成獣胸腺DNAをHindIIIで切断し、J 1ゲノムフラグメントを用いたサザン解析を行った。V 1ゲノムフラグメントを用いたサザン解析を行った。V 2-J 2-J 1組み換え頻度は変異マウスと野生型マウスとで差はなく、V 1組み換え頻度は変異マウスと野生型マウスとで差はなく、V 3-J 3-J 1、V 1、V 4-J 4-J 1、V 1、V 5-J 5-J 1組み換えは両者で検出できなかった。 1組み換えは両者で検出できなかった。 次にV 2-J 2-J 1-C 1-C 1とV 1とV 3-J 3-J 1-C 1-C 1の転写産物の量を半定量的RT-PCR法により、変異マウスと野生型マウスとで比較した。成獣胸腺内では 1の転写産物の量を半定量的RT-PCR法により、変異マウスと野生型マウスとで比較した。成獣胸腺内では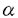 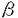 T細胞が大半を占めているが、 T細胞が大半を占めているが、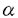  T細胞内ではTCR T細胞内ではTCR の転写は起きないため、成獣胸腺のRT-PCR解析では、V の転写は起きないため、成獣胸腺のRT-PCR解析では、V 2-J 2-J 1-C 1-C 1、V 1、V 3-J 3-J 1-C 1-C 1ともに転写産物を検出することができなかった。胎児期、新生児期におけるV 1ともに転写産物を検出することができなかった。胎児期、新生児期におけるV 2-J 2-J 1-C 1-C 1、V 1、V 3-J 3-J 1-C 1-C 1の転写産物の量は、変異マウスと野生型マウスとの間で特に差は認められなかった。 1の転写産物の量は、変異マウスと野生型マウスとの間で特に差は認められなかった。 最後にV 2、V 2、V 3遺伝子のgermline transcriptionをRT-PCR法で解析した。胎児期、新生児期のgermline transcriptの量は、V 3遺伝子のgermline transcriptionをRT-PCR法で解析した。胎児期、新生児期のgermline transcriptの量は、V 2、V 2、V 3ともに変異マウスと野生型マウスとの間で特に差は認められなかった。成獣期のV 3ともに変異マウスと野生型マウスとの間で特に差は認められなかった。成獣期のV 2のgermline transcriptを検出することはできなかったが、成獣胸腺細胞の多くはすでにV 2のgermline transcriptを検出することはできなかったが、成獣胸腺細胞の多くはすでにV 2-J 2-J 1組み換えを起こしてしまっているためと考えられた。 1組み換えを起こしてしまっているためと考えられた。 以上の結果から、V 2遺伝子をV 2遺伝子をV 4遺伝子の位置に置き換えても、V 4遺伝子の位置に置き換えても、V 2遺伝子が組み換えを起こす時期は変化しないことが明らかとなった。すなわち、V 2遺伝子が組み換えを起こす時期は変化しないことが明らかとなった。すなわち、V 遺伝子が胸腺発生の過程で組み換えを起こす順番は、J 遺伝子が胸腺発生の過程で組み換えを起こす順番は、J 1遺伝子からの距離や順番のみによって決まっているわけではないことが示された。この結果より、TCR 1遺伝子からの距離や順番のみによって決まっているわけではないことが示された。この結果より、TCR 遺伝子座におけるV-J組み換えにおいては、自律調節モデルが当てはまることが示唆された。このモデルにおいては、各V 遺伝子座におけるV-J組み換えにおいては、自律調節モデルが当てはまることが示唆された。このモデルにおいては、各V 遺伝子の近傍にV-J組み換えを制御する調節領域の存在を想定している。V-J組み換えの起こる前にはgermline transcriptionが生じることが報告されていることから、このプロモーターが、TCR 遺伝子の近傍にV-J組み換えを制御する調節領域の存在を想定している。V-J組み換えの起こる前にはgermline transcriptionが生じることが報告されていることから、このプロモーターが、TCR 遺伝子座の時期特異的V-J組み換えを制御する調節領域の候補のひとつとして考えられる。 遺伝子座の時期特異的V-J組み換えを制御する調節領域の候補のひとつとして考えられる。 相同遺伝子組み換えとCre/loxP組み換えを組み合わせて、標的遺伝子組み換えマウスを作成する際には、ES細胞内で両者の組み換えを行い、その後にキメラマウスを得るのがこれまでの通常の方法であった。本研究においては、相同遺伝子組み換えを起こしたES細胞からまずキメラマウスを作成し、その受精卵内でCre/loxP組み換えを行ない、目的とするマウスを得るという方法をとった。受精卵内でのCre/loxP組み換えは非常に効率良く起こり(3匹中3匹)、かつES細胞内でCre/loxP組み換えを行う操作がない分、時間的に早く目的とするマウスを得ることができる。また、操作の過程でES細胞が多分化能を失う危険性を減らすことができる。以上の様な点で、この方法は従来法に比べて優っており、今後同様の手法で標的遺伝子組み換えマウスを作成する際に、非常に有用であると考えられた。 |