| [背景・目的] ヒトにおけるGrowth hormone-releasing hormone(GHRH)によるgrowth hormone(GH)分泌促進作用の検討をおこなうにあたり、正常ヒトGH産生細胞を実験に供することが難しい。そこで、本実験では先端巨大症症例から脳外科的手術により得たヒトGH産生下垂体腺腫を用いることとした。 GHRHはGH産生細胞からのGH分泌を促進させる。ラットGH産生細胞において、GHRHは細胞膜を脱分極させることが知られている。この脱分極反応により活動電位の発火頻度が増加して、電位依存性Ca2+チャネルから細胞内へ流入するCa2+イオンが増加する。GHRHによる脱分極反応やGH分泌促進作用はNa+-freeの細胞外液で消失する。一方、GHRHがGH分泌に重要な細胞内Ca2+濃度([Ca2+]i)を上昇させることも知られており、細胞膜透過性cAMPアナログである8Br-cAMPの投与によっても[Ca2+]iの上昇や、細胞膜の脱分極が起こる。これらの事実は、GHRHがNa+を透過するチャネルを活性化し、さらにこの反応にはGHRHのセカンドメッセンジャーである細胞内cAMP濃度が関与していることを示唆する。しかし、GHRHによって活性化されるNa+透過性チャネルの解析、およびcAMPとの関連性については十分明らかになっていない。そこで本研究ではまず、ヒトGH産生下垂体腺腫細胞を用い、GHRHによって活性化されるNa+透過性チャネルの詳細と、cAMPの関与について検討した。 GHRHがラットおよびヒツジの電位依存性Ca2+チャネル電流を増加することが報告されている。しかし、この増加反応と細胞内cAMPとの関連性については十分明らかにされていない。ヒトGH産生下垂体腺腫細胞にはT型およびL型の電位依存性Ca2+チャネルが存在するが、GHRHによるこれらのチャネルの制御についてはいまだに解明されていない。また、電位依存性Ca2+チャネルがAキナーゼ(PKA)やCキナーゼ(PKC)を介する燐酸化により制御されているとの報告があり、adenylyl cyclaseの活性化と[Ca2+]iには密接な関係があると推論される。しかし、[Ca2+]iとPKAによるチャネルの燐酸化との関連性については明らかにされていない。そこで、今回の第2の研究において、ヒトGH産生下垂体腺腫細胞でのGHRHによる電位依存性Ca2+チャネルの制御と細胞内cAMP濃度との関連、及びこの制御における[Ca2+]iの役割について検討した。 [方法] 経蝶形骨手術にて得られたヒトGH産生下垂体腺腫を酵素的に単離し、培養した。Cushing病症例の経蝶形骨手術標本の非腫瘍部分の一部を酵素的に単離・培養し、正常ヒトGH産生細胞を得た。電気生理実験については、ナイスタチンを用いた穿孔whole-cell clamp法を使用した。標準溶液は、パッチ電極内液(mM);95K aspartate,47.5KCl,1 MgCl2,0.1 ethyleneglycolbis(b-aminoethylether)-N,N,N’,N’-tetraacetic acid(EGTA)(tetramethylammonium(TMA)salt),10 N-2-hydroxyethylpiperazine-N’-2-ethanesulfonic acid(HEPES)(TMA salt,pH7.2)、細胞外液(mM);128NaCl,5KCl,1MgCl2,2.5CaCl2,10HEPES(Na salt,pH7.4)とした。Ca2+チャネルの解析は、細胞内液のK+イオンをCs+イオンに置換し、また細胞外液のCa2+イオンをBa2+イオンに置換して行った。また細胞外液には、1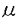 Mのテトロドトキシンを添加した。細胞内Ca2+濃度測定はFura2/AMを用いた2波長励起1波長蛍光測光法を用いた。ホルモン分泌はRIAで測定した。本研究で用いた6個のヒト下垂体腺腫は全てGHRH投与によりGH分泌が有意に増加した。 Mのテトロドトキシンを添加した。細胞内Ca2+濃度測定はFura2/AMを用いた2波長励起1波長蛍光測光法を用いた。ホルモン分泌はRIAで測定した。本研究で用いた6個のヒト下垂体腺腫は全てGHRH投与によりGH分泌が有意に増加した。 [結果]1。ヒトGHRH(hGHRH)により活性化される非選択性陽イオンチャネル 電流固定法下で、hGHRHはヒトGH産生下垂体腺腫細胞の細胞膜を脱分極させた。この脱分極反応をさらに詳細に検討するため電位固定法を用いて検討したところ、hGHRHにより内向き電流の増大とコンダクタンスの増加を認めた。このhGHRHにより惹起される電流の反転電位は-20〜0mVにあるイオンチャネルであることが判明した。このチャネルはNa+、Li+、K+イオンを透過させ、TMA+は透過させないことから、非選択性陽イオンチャネルに合致した。次に、hGHRHによる非選択性陽イオンチャネルの活性化の細胞内情報伝達系について検討した。膜透過性cAMPアナログの8Br-cAMPおよびadenylyl cyclaseを活性化する膜透過性物質のforskolinによりhGHRHと同様の非選択性陽イオンチャネルの活性化が見られ、GHRHの追加投与はさらなる電流量の増大をもたらさなかった。PKA阻害作用のあるRp-cAMPS、H89の前処置、あるいはPKI(5-24)の細胞内投与によって、hGHRHの非選択性陽イオンチャネルの活性化が抑制された。cholera毒の24時間投与後には、hGHRHによる非選択性陽イオン電流増大反応は抑制された。serine/threonine protein phosphatase type1・2Aを抑制するオカダ酸(100nM)あるいはカリクリンA(100nM)の前処置をすると、hGHRHによる非選択性陽イオンチャネルの活性化が非可逆的となった。なお、Cushing病の手術標本より得た正常ヒトGH産生細胞においても、GH産生下垂体腺腫と同様のhGHRHによる内向き電流の増大が認められた。 2。hGHRHによる電位依存性カルシウム電流の増大 ヒトGH産生下垂体腺腫細胞にはT型およびL型の電位依存性Ca2+チャネルが存在し、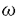 -conotoxin GVIAではCa2+チャネル電流量の変化を認めなかった。hGHRHの投与によってT型およびL型、双方のチャネル電流量の増大を認めた。8Br-cAMPやforskolinはhGHRHと同様に両チャネルの電流量を増大させ、hGHRHの追加投与によっても電流量のさらなる増加は認めなかった。また、Rp-cAMPS、H89の前処置を行うことで、hGHRHによるCa2+チャネル電流増大作用は抑制された。さらに、PKI(5-24)の細胞内投与によってもhGHRHによるCa2+チャネル電流増大作用は抑制された。膜透過性のカルシウム・キレータであるBAPTA/AMを投与すると、ヒトGH産生下垂体腺腫の[Ca2+]iは経時的に低下し、100分後には[Ca2+]iが30nM以下となった。[Ca2+]1が30nM以下となるBAPTA/AM処理100分後では、hGHRHのCa2+チャネル電流増大作用はみられなかった。しかし、BAPTA/AM処理100分後においても、hGHRHによる非選択性陽イオンチャネルの活性化は認められた。また、同条件下でもsomatostatinによるCa2+チャネル電流の抑制が観察された。 -conotoxin GVIAではCa2+チャネル電流量の変化を認めなかった。hGHRHの投与によってT型およびL型、双方のチャネル電流量の増大を認めた。8Br-cAMPやforskolinはhGHRHと同様に両チャネルの電流量を増大させ、hGHRHの追加投与によっても電流量のさらなる増加は認めなかった。また、Rp-cAMPS、H89の前処置を行うことで、hGHRHによるCa2+チャネル電流増大作用は抑制された。さらに、PKI(5-24)の細胞内投与によってもhGHRHによるCa2+チャネル電流増大作用は抑制された。膜透過性のカルシウム・キレータであるBAPTA/AMを投与すると、ヒトGH産生下垂体腺腫の[Ca2+]iは経時的に低下し、100分後には[Ca2+]iが30nM以下となった。[Ca2+]1が30nM以下となるBAPTA/AM処理100分後では、hGHRHのCa2+チャネル電流増大作用はみられなかった。しかし、BAPTA/AM処理100分後においても、hGHRHによる非選択性陽イオンチャネルの活性化は認められた。また、同条件下でもsomatostatinによるCa2+チャネル電流の抑制が観察された。 [考察] hGHRHにより誘発されるNa+イオン透過性チャネルの反転電位は-20〜0mVの間にあり、Na+イオン以外の他の1価のイオンも透過させることから非選択性陽イオンチャネルであると結論された。8Br-cAMPやforskolinを投与することでhGHRHと同様の非選択性陽イオンチャネルが活性化され、hGHRHの追加投与がさらなる電流の増大を示さなかった。このことから、hGHRHが細胞内cAMP濃度の上昇を介して非選択性陽イオンチャネルを活性化することが明らかとなった。さらにPKI(5-24)、Rp-cAMPS、H89がhGHRH誘発電流を消失させたことから、この電流の活性化にはPKAによる燐酸化が必要であることが示唆された。cholera毒処理後はhGHRH誘発電流が消失し、hGHRHによる非選択性陽イオンチャネル活性化にはGs蛋白の介在が示された。しかし、PKAを介した燐酸化により直接的に、あるいはさらにいくつかの制御因子を活性化したのちに、hGHRHが非選択性陽イオンチャネルを開口するのかは現時点では不明である。PKAによる燐酸化がhGHRHの非選択性陽イオンチャネル電流活性化に関与していることから、serine/threonine protein phosphataseがhGHRHの非選択性陽イオンチャネル作用の回復過程に介在している可能性が考えられ、phosphataseの阻害作用を持つオカダ酸あるいはカリクリンAで前処置することで検討を加えた。hGHRHによる陽イオンチャネル作用の回復過程に関与するphosphataseはこれらの物質により阻害することができたため、protein phosphatase type1あるいは2Aが関与していることが示唆された。hGHRHによるGH分泌は、Na+-free外液を用いると消失した。これは、hGHRHによる非選択性陽イオンコンダクタンスがhGHRHのGH分泌に重要であることを示唆する。 今回の研究では、ヒトGH産生下垂体腺腫細胞においてhGHRHがT及びL型Ca2+チャネル電流を増加させることも明らかとした。8Br-cAMPやforskolinがこれらのCa2+チャネル電流量を増大させ、さらにhGHRHを同時投与をしてもさらなる増大がなかった。H89、Rp-cAMPS、PKI(5-24)はhGHRHによるCa2+チャネル電流増大作用を消失させた。以上から、hGHRHがPKAの活性化を介して直接的あるいは間接的に燐酸化を行い、Ca2+チャネル電流量を増加させていると結論された。hGHRHはヒトGH産生下垂体腺腫細胞の非選択性陽イオンチャネル活性化を介して細胞膜を脱分極させる。この脱分極反応が電位依存性Ca2+チャネルを開口して[Ca2+]iを上昇させる。さらに、cAMP-PKAを介したCa2+チャネル電流量増大作用が[Ca2+]iの上昇に相補し、ホルモン分泌が刺激されると考えられた。近年の研究で、いくつかのadenylyl cyclaseの制御には[Ca2+]iが重要であることが明らかとなってきている。今回の研究では、BAPTA/AMで[Ca2+]iを30nM以下にすることによって、hGHRHのCa2+チャネル電流量増大作用が消失した。この30nM以下という[Ca2+]iは、下垂体と同じ興奮性細胞である神経細胞で報告されている生理的な[Ca2+]iよりも十分に低い濃度である。ヒトGH産生下垂体腺腫にどの型のadenylyl cyclaseが存在するかは判明されていないが、hGHRHの電位依存性Ca2+チャネル電流量増大作用には生理的な[Ca2+]iが必要であることが示唆された。しかし、生理的濃度以下の[Ca2+]iの状況下でも、hGHRHによる非選択性陽イオンチャネルの活性化は影響を受けなかった。よって、この[Ca2+]iでもcAMP-PKA systemは障害されないと考えられた。そこで、hGHRHのCa2+電流量増大反応においては、PKA活性化以後のどこかの系で[Ca2+]iの低下が抑制的に働くことが示唆された。クローン化されたL型Ca2+チャネルにおいて燐酸化される部位が指摘されており、生理的な[Ca2+]iがその燐酸化部位に必要である可能性も考えられる。Ca2+依存性Cl-チャネルの燐酸化にも生理的な[Ca2+]iが必要であるとの報告がある。なお、somatostatinの作用は同条件下でも観察され、百日咳毒素感受性G蛋白を介する反応は[Ca2+]iの十分な低下によっても残存するものと考えられた。 ヒトGH産生下垂体腺腫にGs蛋白の点変異が認められるとの報告がある。このような腺腫細胞では、Gs蛋白が持続的に活性化され、細胞内cAMP濃度の基礎値が上昇していると考えられる。しかし、日本での研究ではGs蛋白の点変異はヒトGH産生下垂体腺腫ではかなり稀であるとの報告もある。本研究で用いたヒトGH産生下垂体腺腫は、hGHRHの投与によってGH分泌が刺激されることや、PKAの活性化を介した作用を示すことから、点変異がないものと考えられた。また、正常ヒトGH産生細胞においても腺腫細胞と同様のhGHRHによる内向き電流増大を認めた。そこで、本研究で初めて明らかとなったヒトGH産生下垂体腺腫細胞におけるhGHRHによるイオンチャネルの変化やその細胞内情報伝達系は、正常ヒトGH産生細胞でも同様機構である可能性が示唆された。なお、Gs蛋白の点変異と情報伝達系の擾乱については現在検討中である。 |