| 内容要旨 | | 既存の血管から新たに血管が生じる血管新生と呼ばれる現象は、内皮細胞の増殖と形態形成がその基本である。fms-like tyrosine kinase(flt-1)(Shibuya et al.,1990,Finnerty et al.,1993,Yamane et al.,1994)は、この内皮細胞に特異的に発現が認められる受容体型チロシンキナーゼである。最近、生理的な血管新生因子として知られている血管内皮細胞増殖因子(VEGF)(Ferrara et al.,1989,Rosenthal et al.,1990,Connolly et al.,1991)が、Flt-1とその類似体であるKDR/Flk-1のリガンドであることが報告された(de Vries et al.,1992,Terman et al.,1992)。さらに、flt-1、KDR/flk-1遺伝子欠損マウスでは、胎生期の血管及び血島の形成が著しく障害された事が報告されている(Fong et al.,1995,Shalaby et al.,1995)。これらの事から、flt-1及びKDR/flk-1は、内皮細胞の分化および増殖に必須の遺伝子である事が示された。 本研究では、このflt-1遺伝子に着目し、その遺伝子構造を明らかにすることにより、受容体型チロシンキナーゼの働きを知る上での基礎的な情報を提供することを目的として行った。 1:マウスflt-1 mRNAレベルでの解析 マウス肺cDNAライブラリーから、ラットflt-1 cDNA(Yamane et al.,1994)をプローブとして、flt-1 mRNA(6.6Kb,6.5Kb,3.3Kb)をコードする陽性クローンを得た。M9及びM11クローンは、細胞外領域にシグナルペプチドを含む7個の免疫グロブリン様構造(Ig)と、膜通過領域及びチロシンキナーゼ領域とから成るflt-1遺伝子(Finnerty et al.,1993)の一部をコードするクローンであった。一方、MDクローンは、3.3Kb flt-1 mRNAのほぼ全長3,377bpを含み、中に688個と推定されるアミノ酸配列をコードしていた。又、5’側2,223番まではflt-1遺伝子と同じ配列を持ち、残りは全てintron13に含まれる配列であった。解析の結果、3.3Kb flt-1 mRNAは、Flt-1の第7-Igドメインと細胞内領域を欠損した分泌型Flt-1タンパク質(sFlt-1)をコードする遺伝子である事が分かった。さらに、intron13に由来する配列には、sFlt-1に特異的な31個のアミノ酸がコードされていた。このsFlt-1特異的C末端アミノ酸配列は、先にKendallら(1993)の報告したヒトsFlt-1と高い相同性(87%)を示した(図1)。さらに、その全体構造も類似し、両遺伝子は同じ機構によるflt-l preRNAからのalternative splicingの結果生じた遺伝子である事が分かった。一方、ヒトsFlt-1は、VEGFと高い親和性を示し、VEGFにより誘導されるhuman umbilical vein endothelial cell(HUVEC)のmitogenesisを阻害することが報告されている(Kendall et al.,1993)。マウスsFlt-1発現sf9細胞のC末端特異的抗体を用いたウエスタン解析から、sFlt-1タンパク質が、in vivoで細胞外に分泌される事を確認した。また、KDRの分泌型isoformは確認されていない事から、sFlt-1タンパク質は、endogenous VEGF阻害剤などとして、生物学的に重要な機能を持つ事が示唆された。 2:マウスflt-1ゲノムDNAの解析 flt-1遺伝子のプロモター領域には、TATA boxが存在し、そのさらに上流130塩基以内には、ets、CREB/ATF応答配列が存在していた。ヒトflt-1プロモーター領域に存在する、CREB/ATF配列とその直下にあるets配列は、flt-1遺伝子の内皮細胞特異的な発現に必須の配列である事が報告されている(Morishita et al.,1995,Ikedaet al.,1996,Wakiyaet al.,1996)。ヒトとマウスの同領域が良く保存されているのに対して、KDR遺伝子のプロモーター領域(Patterson et al.,1995)との相同性は認められなかった。この事から、二つの遺伝子は、内皮細胞内で異なる転写調節を受けている可能性が示唆された。 flt-1遺伝子は、約140Kb以上から成り、30個のエキソンから構成され(図2)、全てのスプライスドナーとアクセプターの塩基配列は、(GT--AG)の法則(Padget et al.,1986)に従っていた。細胞外領域は15個のエキソンにコードされ、100Kb以上の広い範囲に分布していた。一方、細胞内領域は14個のエキソンにコードされ、約38Kb以内の遺伝子上に平均して分布していた。 sflt-1遺伝子とflt-1遺伝子の3’non-coding regionは、それぞれintron13とexon30に全て含まれていた。開始メチオニンを含むシグナルペプチドは、immunogulobulin superfamilyなどと共通し(Williams et al.,1988)、一つのエキソン(exon1)にコードされていた。 3:fms/fltファミリーとの比較 一方、7個のIgドメインを持つfltファミリー(flt-1,KDR/flk-1,flt-4)と、5個のIgドメインを特徴とするfmsファミリー(c-fms,c-Kit,PDGFR,flk-2/flt3)は、その構造上の類似から、fms/flt supergene familyと呼ばれる遺伝子群を形成し(Shibuya,1995)、共通の先祖遺伝子からcis duplicationさらにtrans duplicationを経て進化した事が知られている(Andre et al.,1992,Rosnet et al.,1993)。この事から、flt-1遺伝子と、c-fms、c-kit、及び一部解析されているflt-4遺伝子について、コードされているアミノ酸配列及びエキソン・イントロン構造での比較を行った。アミノ酸レベルでのアライメントからは、細胞外領域で強く保存された領域は認められなかったが、immunoglobulin superfamilyの間で共通に存在するアミノ酸は、両ファミリーでも良く保存されていた。しかしながら、Fmsファミリーの第1-Ig、第2-Igドメインが、それぞれ1個のエキソンに含まれているのに対して、Flt-1では各々2個のエキソンにコードされ、間にイントロンが存在していた。又、Flt-1の第5-Igドメインは3個のエキソンにコードされていた。一方、カイネースインサート(KI)とC末端領域を除く細胞内領域では、アミノ酸配列及びエキソン・イントロン構造とも良く保存されていた。 これらの結果を基に、fms/fltファミリーの共通の先祖遺伝子モデルを推察した。その中から、7-Igタイプ(exon theory:Doolittle 1978,Kwiatowski et al.,1995)または5-Igタイプ(introns-late theory:Logsdon et al.,1995)を支持したいと考える。 5/7-Ig型先祖遺伝子から、cis duplicationにより1種類の7-Ig型遺伝子と2種類の5-Ig型遺伝子が生じ、さらに、ヒトとマウスが分岐する以前にtrans duplicatonが生じ、現在の3種類のfltファミリーと、6種類と推定されるfmsファミリー(Rosnet et al.,1993)の各遺伝子が出来たと推定される。 本遺伝子の解析結果は、受容体型チロシンキナーゼの働きを知るうえでの基礎的情報を提供するものと考えられる。 文献Andre,C.,et al.(1992).Oncogene7,685-691.Connolly,D.(1991).J.Cell.Biochem.47,219-223de Vries,C.,et al.(1992).Science255,989-991.Doolittle,W.F.(1978).Nature(London)272,581-582.Ferrara,N.,et al.(1989).Biochem.Biophys.Res.Commun.161,851-858.Finnerty,H.,et al.(1993).Oncogene8,2293-2298.Fong,G.H.,et al.(1995).Nature376,66-70.Ikeda,T.,et al.(1996).Growth factors,13,151-162.Kendall,R.,et al.(1993).Proc.Natl.Acad.Sci.USA90,10705-10709.Kwiatowski,J.,et al.(1995).Proc.Natl.Acad.Sci.USA92,8503-8506.Logsdon,Jr.,et al.(1995).Proc.Natl.Acad.Sci.USA92,8507-8511.Morishita,K.,et al.(1995).J.Biol.Chem.270,27948-27953.Padgett,R.A.,et al.(1986).Ann.Rev.Biochem.55,1119-1150.Patterson,C.,et al.(1995).J.Biol.Chem.270,23111-23118.Rosnet,O.,et al.,(1993).Oncogene8,173-179.Rosenthal,R.A.,et al.(1990).Growth Factors4,53-59.Shalaby,F.,et al.(1995).Nature376,62-66.Shibuya,M.,et al.(1990).Oncogene5,519-524.Shibuya,M.(1995).Adv.Cancer Res.,67,281-316.Terman,B.,et al.(1992).Biochem.Biophys.Res.Commun.187,1579-1586.Wakiya,K.,et al.(1996).J.Biol.Chem.272,(in press)Williams,A.,et al.(1988).Ann.Rev.Immunol.6,381-404.Yamane,A.,et al.(1994).Oncogene9,2683-2690.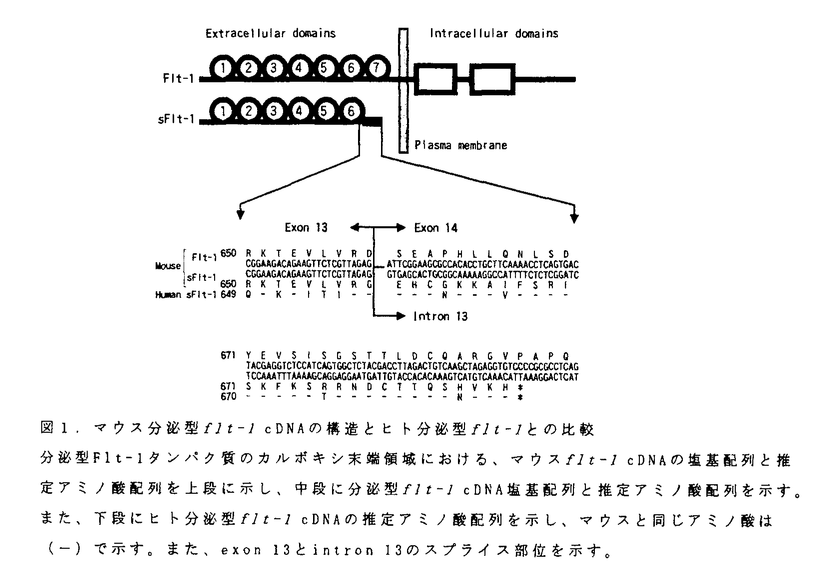 図1.マウス分泌型flt-1 cDNAの構造とヒト分泌型flt-1との比較分泌型Flt-1タンパク質のカルボキシ末端領域における、マウスflt-1 cDNAの塩基配列と推定アミノ酸配列を上段に示し、中段に分泌型flt-1 cDNA塩基配列と推定アミノ酸配列を示す。また、下段にヒト分泌型flt-1 cDNAの推定アミノ酸配列を示し、マウスと同じアミノ酸は(-)で示す。また、exon 13とintron 13のスプライス部位を示す。 図1.マウス分泌型flt-1 cDNAの構造とヒト分泌型flt-1との比較分泌型Flt-1タンパク質のカルボキシ末端領域における、マウスflt-1 cDNAの塩基配列と推定アミノ酸配列を上段に示し、中段に分泌型flt-1 cDNA塩基配列と推定アミノ酸配列を示す。また、下段にヒト分泌型flt-1 cDNAの推定アミノ酸配列を示し、マウスと同じアミノ酸は(-)で示す。また、exon 13とintron 13のスプライス部位を示す。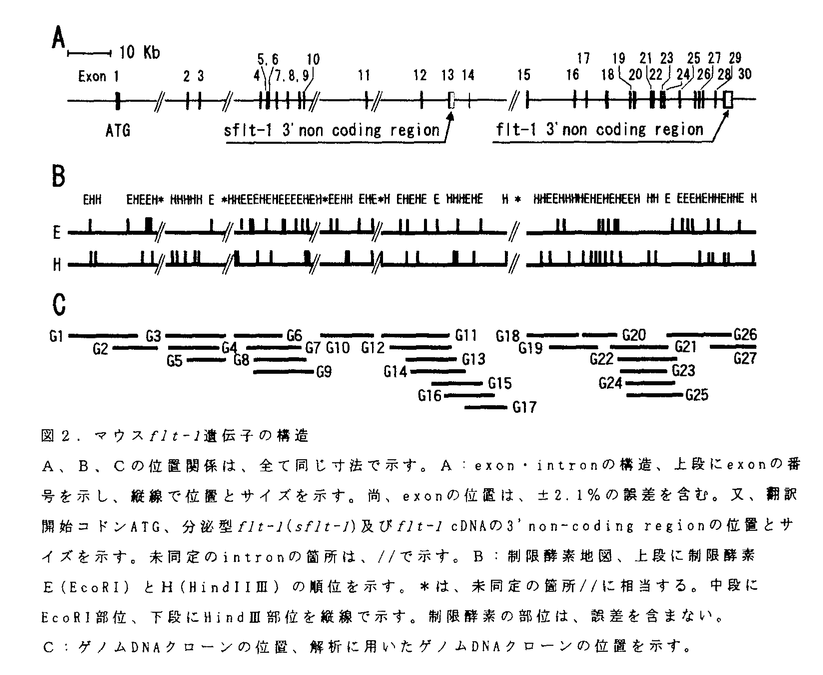 図2.マウスflt-1遺伝子の構造A、B、Cの位置関係は、全て同じ寸法で示す。A:exon・intronの構造、上段にexonの番号を示し、縦線で位置とサイズを示す。尚、exonの位置は、±2.1%の誤差を含む。又、翻訳開始コドンATG、分泌型flt-1(sflt-1)及びflt-1 cDNAの3’non-coding regionの位置とサイズを示す。未同定のintronの箇所は、//で示す。B:制限酵素地図、上段に制限酵素E(EcoRI)とH(HindIIIII)の順位を示す。*は、未同定の箇所//に相当する。中段にEcoRI部位、下段にHindIII部位を縦線で示す。制限酵素の部位は、誤差を含まない。C:ゲノムDNAクローンの位置、解析に用いたゲノムDNAクローンの位置を示す。 図2.マウスflt-1遺伝子の構造A、B、Cの位置関係は、全て同じ寸法で示す。A:exon・intronの構造、上段にexonの番号を示し、縦線で位置とサイズを示す。尚、exonの位置は、±2.1%の誤差を含む。又、翻訳開始コドンATG、分泌型flt-1(sflt-1)及びflt-1 cDNAの3’non-coding regionの位置とサイズを示す。未同定のintronの箇所は、//で示す。B:制限酵素地図、上段に制限酵素E(EcoRI)とH(HindIIIII)の順位を示す。*は、未同定の箇所//に相当する。中段にEcoRI部位、下段にHindIII部位を縦線で示す。制限酵素の部位は、誤差を含まない。C:ゲノムDNAクローンの位置、解析に用いたゲノムDNAクローンの位置を示す。 |