細胞の最終分化には、通常増殖の停止を伴い、細胞周期制御が深く関っている。細胞周期制御において、G1期は細胞周期の進行を決定づける重要なポイントであり、この制御には、G1サイクリン(cyclin)およびそれらに対応するサイクリン依存性キナーゼ(cyclin-dependent kinase,CDK)が中心的役割を果たしている。さらに、p21/WAF1/SDI1/CIP1、p27/KIP1、p16/INK4Aなどの細胞周期を抑制的に制御するサイクリン依存性キナーゼ抑制因子(CDK inhibitor,CKI)が深く関与していると考えられている。CKIのうちp21は、血液細胞を含むいくつかの細胞において最終分化との関連が示唆されている。 一方、細胞周期制御の乱れは、発癌において重要な役割を果たす。多くの癌遺伝子や癌抑制遺伝子が細胞周期制御に関連することが示されているが、そのうちbcl-1/PRAD1癌遺伝子はG1期を制御するG1サイクリンのサイクリンD1をコードしている。マントル細胞リンパ腫、およびいくつかのB細胞腫瘍においては、t(11;14)(q13;q32)染色体転座、すなわちbcl-1/PRAD1癌遺伝子の再構成を分子機序としたサイクリンD1の過剰発現が共通した特徴として見られ、これらの腫瘍発生に本質的な役割を果たしていると考えられる。そこで血液細胞の分化ならびに腫瘍化に伴う細胞周期制御機構を明らかにすることを目的に、最終分化に伴う増殖停止におけるG1サイクリンの発現とCKIの関与、ならびに腫瘍化に伴うG1サイクリンの発現を解析した。 血液細胞の分化に伴う増殖停止の分子機構を、フォルボルエステル(TPA)による分化モデルを用いて検討した。10nMのTPA添加により、巨核球系細胞株MEG-01sは増殖を停止するとともに、CD41抗原の発現増強、細胞膜の出芽様変化など巨核球系分化形質が誘導される。フローサイトメトリーによる解析では、TPA添加後細胞は細胞周期上G0/G1期に集積する。G1-S移行期に細胞周期同調したMEG-01sにTPAを添加すると、細胞はS期、G2/M期を容易に通過し次のG0/G1期で進行を停止した。ノザン解析、ウエスタン解析により各種細胞周期関連因子の発現レベルを検討すると、G1サイクリンであるサイクリンEmRNA、蛋白がTPA添加により高発現となり、免疫組織化学的にも約8割の細胞にサイクリンEが検出されるようになることから、MEG-01sはサイクリンEを発現するG1-S移行期に細胞周期を停止すると考えられる。また、TPAはサイクリン依存性キナーゼ抑制因子であるp21/WAF1/SDI1/CIP1およびp27/KIP1の発現を誘導した。細胞周期同調系における検討では、p21の発現は細胞周期非依存性であるが、p27の発現は細胞周期依存性であることが示唆された。MEG-01sを10nMTPA添加培養した細胞抽出物を用いて、p21、p27のサイクリンE複合体への結合を免疫沈降ウエスタン解析で検討したところ、TPA添加により発現誘導されたp21、p27は、いずれもサイクリンE複合体と結合した。ヒストンH1、Rbキナーゼアッセイの結果、サイクリンE複合体のヒストンH1、およびRbキナーゼ活性はTPA添加によりほぼ完全に抑制されていた。これらの結果から、TPAによるMEG-01s細胞の分化誘導に伴う細胞周期停止機構の少なくとも一部は、p21およびp27がサイクリンE-CDK2複合体に結合して、これを不活化することであることが示唆された。しかし、MEG-01s細胞の増殖に影響しない10nM未満のTPAでp27蛋白の発現が誘導されることから、p27蛋白の発現単独ではTPAによる分化に伴う細胞周期停止には不十分と考えられた。 TPAによる分化誘導モデルでは、G1サイクリンの発現レベルの変化を伴うことがこれまでにも他の細胞株を用いて報告されているが、その意義については明確ではない。TPAによるMEG-01sの分化誘導系においては、TPAがサイクリンEを直接発現誘導するのではなく、G1-S移行期で細胞周期が停止することでサイクリンE高発現状態となっている。その分子機構の少なくとも1つは、TPAで発現誘導されるp21およびp27が、サイクリンE複合体のキナーゼ活性を抑制することであることが示された。このp21の発現誘導はこれまでの報告と同様にp53非依存性であると考えられた。p21に加えp27も必要であるかどうかは今後さらに検討を要する。今回の我々の結果は細胞分化に伴う増殖停止におけるG1サイクリン発現の意味、およびp21、p27の果たす役割を示唆していると考えられ、正常造血におけるこれらの細胞周期制御因子の果たす役割について、さらに検討する必要がある。 次に、造血における細胞周期制御を検討することを目的に、各種D型サイクリンの相対的発現レベルを検出することのできる競合的RT-PCR法を塩基配列の相同性を利用して考案した。上流側のプライマーを、サイクリンD1と他のD型サイクリンであるサイクリンD2、D3に相同な領域に一つ設定し、これら3つのD型サイクリンに特異的なプライマーを下流側にそれぞれ1つずつ計3つ設定してPCRを行なった。3つのD型サイクリンの配列のPCR増幅に上流側のプライマーが共有されるので、それぞれのPCR産物はお互いに競合し合う。よって、3つのPCR産物を比較することで、D型サイクリン遺伝子発現量を半定量的に比較することができると考えられる。3種のD型サイクリン全てを高発現するMEG-01sから抽出したRNAを用いて、上流側および下流側のプライマーの種々の組み合わせによりRT-PCRを行なうと、期待されるサイズのPCR産物が検出され、それぞれ対応するD型サイクリンであることがサザン解析で確認された。このPCRの反応を32Pの取り込みで検討したところ、24-27サイクルまではPCR産物は対数的に増加し、プラトーに達した後も各産物の相対的量比を保っていた。検出感度と特異性を考慮して以下の実験は30サイクルで行なった。各D型サイクリンを含むプラスミドを用いて種々の組み合わせ、および量比でこの競合的RT-PCRを行なうと、それぞれの組み合わせに対応する期待されるサイズのPCR産物が増幅され、また各PCR産物は反応系に加えた各プラスミドの量比を反映した。以上の結果から、この競合的RT-PCR法は各D型サイクリンのmRNAを特異的に増幅し、各産物が競合し合うことで遺伝子発現量の相対的量比を検出することが可能である。各種血液系細胞株およびt(11;14)関連疾患の臨床検体を用いた検討では、本法はノザン解析の結果と非常に良い相関を示す上、検出感度にやや優れていた。また相対的発現レベルを同時に比較するため、t(11;14)関連疾患におけるサイクリンD1の過剰発現を、本法は明瞭に、そして容易に検出し得た。 この検出法を用いて、我々は血液系細胞株45株および臨床検体40検体の検討を行なった。サイクリンD3は検討したすべての細胞株および検体で発現が見られたが、サイクリンD1、D2については、細胞株もしくは検体により異なっていた。リンパ系細胞株においては、サイクリンD1はt(11;14)転座を有するB細胞株に強い発現が検出されたが、その他の細胞株はほとんど発現が見られなかった。一方、顆粒球系細胞株では、サイクリンD1、D2は種々の組み合わせで発現が見られ、一定の傾向は見出せなかった。これらの結果から、サイクリンD3は造血細胞で普遍的な役割を果たし、サイクリンD1、D2は細胞の系統、もしくは分化段階に関連した機能を持つ可能性が示された。また、顆粒球系細胞株における発現様式は、細胞系統よりむしろ腫瘍化機構に関連している可能性も考えられた。臨床検体の末梢血では、サイクリンD1を高発現しているt(11;14)転座を持つB細胞腫瘍もしくはマントル細胞リンパ腫症例以外は、サイクリンD1をほとんど検出できなかった。これらの細胞株、臨床検体の各種サイクリンの相対的発現量を検討すると、t(11;14)転座を持つB細胞腫瘍およびマントル細胞リンパ腫症例においては、サイクリンD1の発現量はサイクリンD2、D3の発現量の合計を上回り、他の症例と明瞭に鑑別することが可能であった。また、HTLV-1感染T細胞株ではサイクリンD2の相対的発現量が明らかに高く、他の細胞株と異なっていた。本法はサイクリンD1過剰発現だけではなく、成人T細胞白血病のようにサイクリンD2を高発現する血液悪性腫瘍の検出にも有用と考えられた。 これまでも、t(11;14)転座もしくはサイクリンD1の過剰発現の検出にPCRを用いた解析結果が報告されている。DNAを用いてt(11;14)転座を検出する場合、bcl-1の転座切断点が広領域に及ぶことから検出率が低くなる。また、RNAからサイクリンD1だけを増幅している報告があるが、その量的な解析には、厳密な条件設定が必要である。今回の検出法を用いれば、わずか100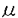 lという微量な末梢血臨床検体を用いて、特にコントロールを置くことなくサイクリンD1の過剰発現を検出することが可能である。この迅速かつ信頼性の高いサイクリンD1過剰発現検出法は、B細胞腫瘍の解析および治療に臨床的に有用であろう。また、微量な検体で可能なため、本法を用いて正常造血におけるD型サイクリン、特にサイクリンD1、D2の発現様式を解析しその役割を検討することが可能であると考えられる。 lという微量な末梢血臨床検体を用いて、特にコントロールを置くことなくサイクリンD1の過剰発現を検出することが可能である。この迅速かつ信頼性の高いサイクリンD1過剰発現検出法は、B細胞腫瘍の解析および治療に臨床的に有用であろう。また、微量な検体で可能なため、本法を用いて正常造血におけるD型サイクリン、特にサイクリンD1、D2の発現様式を解析しその役割を検討することが可能であると考えられる。 |