学位論文要旨
| No | 213446 | |
| 著者(漢字) | 鳥山,正晴 | |
| 著者(英字) | ||
| 著者(カナ) | トリヤマ,マサハル | |
| 標題(和) | 二座配位型キラルリチウムアミドを用いた4-置換シクロヘキサノン類の不斉脱プロトン化反応の立体化学 | |
| 標題(洋) | ||
| 報告番号 | 213446 | |
| 報告番号 | 乙13446 | |
| 学位授与日 | 1997.07.09 | |
| 学位種別 | 論文博士 | |
| 学位種類 | 博士(薬学) | |
| 学位記番号 | 第13446号 | |
| 研究科 | ||
| 専攻 | ||
| 論文審査委員 | ||
| 内容要旨 | エノラートイオンは有機合成化学に於ける最も基本的な化学種であり、この中間体を経由して様々な反応が行われる。本研究は、キラルリチウムアミドを用いてプロキラルなカルボニル化合物をエナンチオ選択的に対応するキラルなリチウムエノラートに変換する不斉合成反応について、キラルリチウムアミドの化学構造変化に伴う反応の立体化学の変化を調べることにより、本不斉反応の立体化学的機構を解明することを目的としたものである。 分子内に対称面を有するプロキラルな4-置換シクロヘキサノン類(1)を種々のキラルリチウムアミドを用いて脱プロトン化し、生成するキラルなリチウムエノラート(2)をシリルエノールエーテル(3)として単離する反応は、二座配位型キラルリチウムアミド(4)を用いると高い不斉誘起能を示すことが既に知られていた。しかし、本不斉脱プロトン化反応の立体化学的な反応機構については、なお疑問が残っていた。そこで、4の不斉炭素上のフェニル基を変換したキラルリチウムアミド(5〜9)、及び4のピペリジノ基を変換したキラルリチウムアミド(10〜13)を設計、合成し、キラルリチウムアミドの構造変化に伴う脱プロトン化反応の立体化学の変化を追求した(Figure1)。 過剰量の塩化トリメチルシリル存在下(Internal Quench法)、1の脱プロトン化反応を(R)-5〜(R)-9を用いて行った。結果をTable1に示す。 4位置換基がメチル基である1aの脱プロトン化反応では、(R)-5〜(R)-7を用いた場合に高い不斉収率で(R)-3aが得られ、その不斉収率の程度は、(R)-4を用いた場合と大きく変化することはなかった。 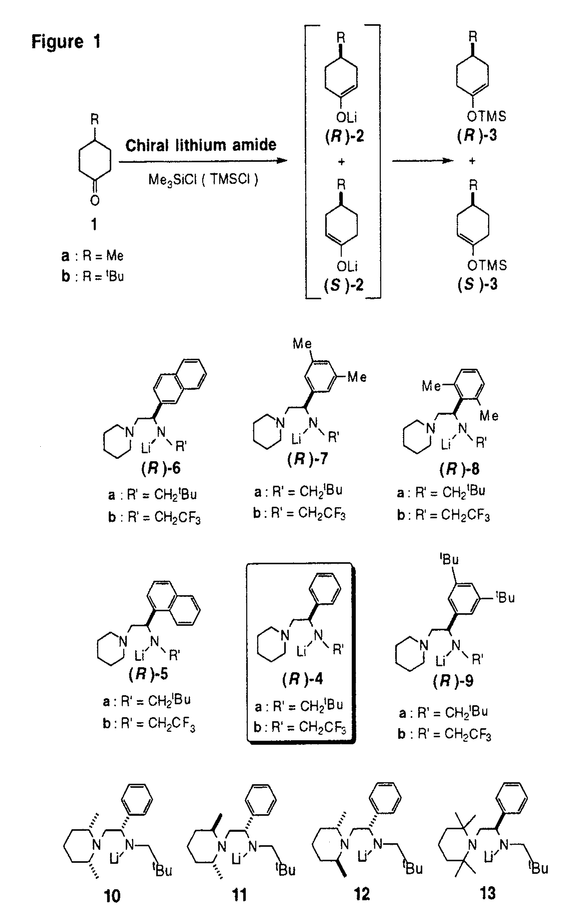 しかし、(R)-8、(R)-9を用いると、(R)-3aの不斉収率はかなり低下するのが認められた。 一方、4位置換基が嵩高いtert-ブチル基である1bの脱プロトン化反応では、(R)-5を用いた場合に(R)-3bが高い不斉収率で得られ、(R)-4を用いた場合と同様であるものの、(R)-6、(R)-7、(R)-8に於いては不斉収率がかなり低下し、(R)-9を用いた場合には殆ど不斉が誘起されないか、或いは、低い不斉収率で(S)-3bが得られた。 上記の立体選択性の変化を考察すると、(R)-4による1の脱プロトン化反応によって(R)-3を与える反応の遷移状態は、(R)-4の不斉炭素上のフェニル基がより嵩高くなってくると、基質である1の4位置換基と立体的に不利な相互作用が生じるような構造であることを示唆している。 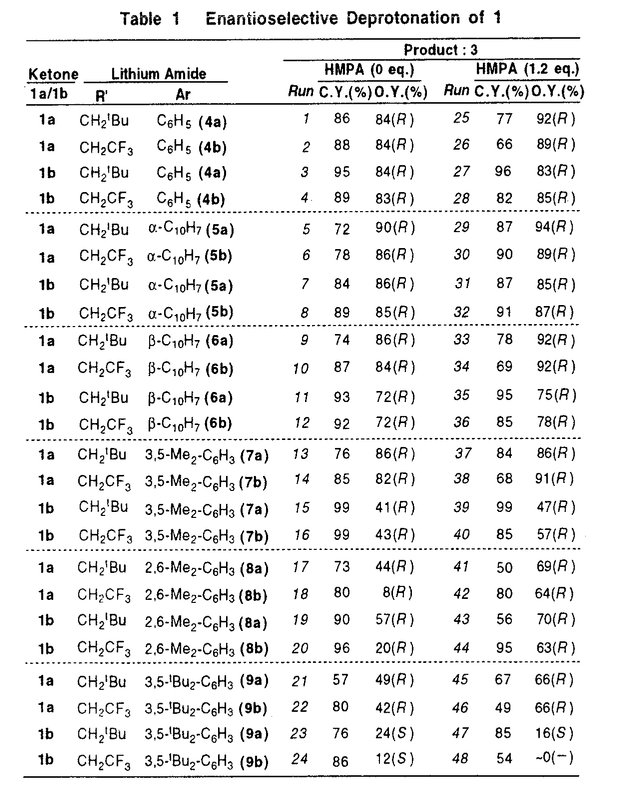 4aのピペリジノ基を置換ピペリジノ基に変換した10〜13による1bの脱プロトン化反応では、13を用いたときに顕著な不斉収率の低下が認められた。これは、2,2,6,6-テトラメチルピペリジノ基がその立体障害により、リチウムに対する分子内配位子として機能し難くなっている為と理解される。このことは、二座配位型キラルリチウムアミドを用いて高い選択性を得る為には、キレート構造の生成が必須であることを示唆している。 塩化トリメチルシリル非存在下に1の脱プロトン化反応を行ってリチウムエノラート(2)とし、これを塩化トリメチルシリルと反応させて3とする方法(External Quench法)を用いると、上記のInternal Quench法による脱プロトン化反応の場合と比較して、3の不斉収率が少し低下すること、また、臭化リチウムを最初から添加しておくと、3の不斉収率の程度がInternal Quench法で行った場合の程度にまで回復することを見出した。 この事実は、Internal Quench法に於ける塩化トリメチルシリルの役割は、生成するリチウムエノラートを即座にシリル化するのみではないことを示している。シリル化によって塩化リチウムが生成するので、これがキラルリチウムアミドの溶液構造を変化させていると考えられる。 6LiClの非存在下及び存在下に於ける[6Li,15N2]-(R)-4aのTHF-d8中での溶液構造を6Li-及び15N-NMRによって調べた。その結果、(R)-4aはTHF中ではキレート構造の単量体(14)であるが、LiCl存在下では(R)-4aとLiClからなる混合二量体(15)になっていることが判明した。従って、(R)-4aを用いるInternal Quench法による本不斉脱プロトン化反応に於けるキラルリチウムアミドの構造は15であると結論される(Figure2)。 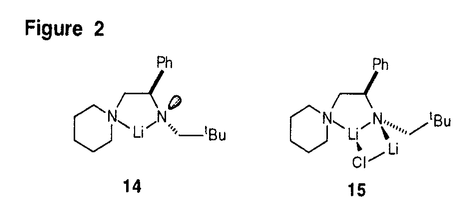 Internal Quench法を用いた本不斉脱プロトン化反応に於いて、混合二量体(15)が基質(1)を脱プロトン化する機構は、基質のカルボニル酸素が15のLiClのリチウムに配位し、生じたキラル窒素上の孤立電子対がカルボニル基の  | |
| 審査要旨 | エノラートイオンは有機合成化学に繁用される基本的な化学種である。二座配位子型のキラルリチウムアミドを用いてプロキラルな4-置換シクロヘキサノン(1)をエナンチオ選択的に脱プロトン化して対応するキラルリチウムエノラート(2)に変換し、シリルエノールエーテル(3)として単離する不斉合成反応は、すでに報告されている。しかし、本不斉反応の立体化学的な機構については、なお疑問が残っている。本研究は、二座配位子型キラルリチウムアミドの構造変化に伴う反応の立体化学の変化を調べることにより、この問題を追求したものである。
本不斉脱プロトン化反応についてはすでに、4a,bがかなりの不斉誘起能を示すことが報告されており、それらの溶液構造も判明している。そこで、4a,bの不斉炭素上のフェニル基をより嵩高い置換基に変換した5〜9、及び4aのピペリジノ基の窒素の近傍をより嵩高くした10〜13を光学活性体として合成した。 過剰量の塩化トリメチルシリル(TMSCl)の存在下にTHF中で脱プロトン化反応を行った。基質に1aを用いた場合には、4a,b〜7a,bによってほぼ同様の立体選択性が得られたものの、8a,b〜9a,bでは立体選択性の低下が認められた。一方、基質に1bを用いた場合には、4a,b〜5a,bによってほぼ同程度の立体選択性が得られたものの、6a,b〜8a,bで立体選択性の低下が認められ、9aでは生成物の立体配置が逆転し、9bでは生成物は殆どラセミ体であることが判明した。これらの事実から、本不斉反応の遷移状態において、4の不斉炭素上のフェニル基がより嵩高くなると、基質である1の4位置換基との間に、立体的な相互作用が増大するような構造であることを示唆している。
10〜13の中で、13を用いた時に立体選択性の低下が認められた。この事実は、2,2,6,6-テトラメチルピペリジノ基はその嵩高さのために、分子内配位子として充分には機能しえないことを示唆している。 TMSCl非存在下に脱プロトン化反応を行って後にTMSClでシリル化して得られた生成物は、TMSCl存在下に反応を行った場合に比べ、その光学純度が若干低下していることが認められた。[6Li,15N2]-(R)-4aおよび6LiClを用いた6Li,15N-NMRによる検討の結果、LiClが存在すると(R)-4aは溶液中でそれらの混合二量体(14)として存在し、これがTMSCl存在下での反応を支配していることが示された。 上記の結果から、(R)-4aを用いた本不斉脱プロトン化反応の立体化学的反応機構として、8員環遷移状態(15)が最も妥当であると結論した。
以上本研究は、二座配位子型キラルリチウムアミドを用いた不斉脱プロトン化反応の立体化学を詳細に検討し、TMSCl存在下での本反応が8員環遷移状態を経由する証拠を提出したものであり、有機立体化学に寄与するものとして、博士(薬学)に値するものと認める。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/51053 |

 位のプロトンをとる八員環の遷移状態(エナンチオトピックなプロトンに対してそれぞれ16、17)が妥当であると考えられる。このとき、窒素-水素-炭素を直線上に配列すると、17がより低エネルギー状態にあると推察される。17は、本不斉脱プロトン化反応の立体化学を説明すると共に、脱プロトン化反応に於いて見られた4aの不斉炭素上のフェニル基と、1の4位置換基との立体的相互作用の存在も示している(Figure3)。
位のプロトンをとる八員環の遷移状態(エナンチオトピックなプロトンに対してそれぞれ16、17)が妥当であると考えられる。このとき、窒素-水素-炭素を直線上に配列すると、17がより低エネルギー状態にあると推察される。17は、本不斉脱プロトン化反応の立体化学を説明すると共に、脱プロトン化反応に於いて見られた4aの不斉炭素上のフェニル基と、1の4位置換基との立体的相互作用の存在も示している(Figure3)。