| [目的] ヒト肝細胞癌の肝内転移は臨床においてしばしば認められ、その予後を規定する因子として重要である。肝内転移は経門脈性に腫瘍細胞が散布されることにより生じるが、その形成に関わる分子機構は未だ不明である。そこでヒト肝細胞癌株Li7から肝転移能の異なる亜株を樹立し、細胞構成蛋白の分析や細胞動態の解析を通してそれらの細胞を比較し、どのような因子が肝細胞癌の肝内転移に関与しうるかを検討した。 [方法] 転移性の異なる亜株の樹立とその比較検討: ヒト肝細胞癌株Li7のマウス脾臓への注入を繰り返して樹立した高転移株Li7HM(highly metastatic)と、低転移性の親株Li7のクローニングにより樹立した非転移株Li7NM(non metastatic)の差を、その細胞構成蛋白の比較や細胞接着・浸潤能の比較により検討した。 構成蛋白は2次元電気泳動(1次元目:等電点電気泳動、2次元目:SDS-PAGE)およびイムノプロット・免疫染色を用いて解析し、2次元電気泳動にて差の見られた蛋白は内部アミノ酸シークエンス解析により同定した。 in vitroにてマウス肝細胞および肝類洞内皮細胞に対する接着アッセイ、Boyden chamberを用いた浸潤アッセイおよびマウス肝細胞monolayerに対する浸潤アッセイを行い、腫瘍細胞の接着、浸潤能を比較した。 遺伝子導入による肝転移能変化の検討: 高転移株のみに見られた蛋白を遺伝子導入の手技により非転移株Li7NMに発現させ、肝転移能に変化が生じるかを検討した。 [結果] Li7両細胞亜株の転移能/腫瘍形成能: Li7HM細胞は脾注後高率に多発性の肝転移を形成したが、Li7NMは全く肝転移を形成しなかった。皮下における腫瘍形成能に差はなかったが、細胞浮遊液肝注後の肝における腫瘍形成はLi7HM細胞にのみ認められた。尾静脈注入後の肺転移や皮下注入後の自然肝/肺転移は両亜株とも形成しなかった(表1)。 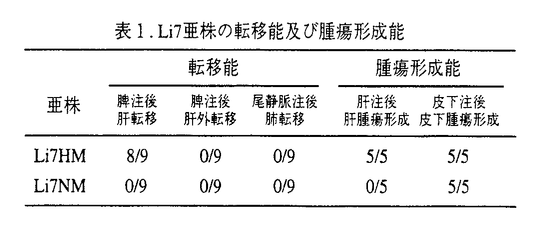 表1.Li7亜株の転移能及び腫瘍形成能 表1.Li7亜株の転移能及び腫瘍形成能 Li7両細胞亜株の細胞構成蛋白: 2次元電気泳動の解析にて差のみられたスポットの、アミノ酸シークエンスにより、Li7HMにサイトケラチン8がより強く、Li7NMにビメンチンが特異的に発現している事がわかった。 イムノブロット、免疫細胞染色による比較では、Li7HM細胞にのみE-カドヘリンの発現を見、細胞間接着部に陽性染色を認めた(表2)。 Li7両細胞亜株の接着/浸潤能の評価: マウス肝細胞と肝類洞内皮に対する接着は、高転移株Li7HMにおいてより強く認められた。Boyden chamberや肝細胞monolayerへの浸潤性はむしろLi7NM細胞の方が強かった(表2)。  表2.Li7亜株の発現蛋白および接着/浸潤能 表2.Li7亜株の発現蛋白および接着/浸潤能 E-カドヘリン導入細胞の転移形成能: 非転移株Li7NMへのE-カドヘリン導入細胞(EM16.21B.3)は脾注後に肝転移を形成した(8匹/16匹)が、コントロール細胞(Neo4B.2)では肝転移を認めなかった(0匹/13匹)。皮下腫瘍の形成に差は見られなかったが、肝注後の肝腫瘍形成はやはりEM16.21B.3細胞にのみ認められた(11匹/13匹)(表3)。  表3.E-カドヘリン導入細胞の肝転移能および肝腫瘍形成能 表3.E-カドヘリン導入細胞の肝転移能および肝腫瘍形成能 なお、親株(Li7NM)、コントロール細胞とE-カドヘリン導入細胞との間に、肝細胞monolayerへの浸潤性に有意な差を認めたが、他の接着/浸潤アッセイでは転移能の差を反映するような傾向は見られなかった。 [考察] 肝転移能の異なる亜株の細胞構成蛋白の比較検討から、Li7HM細胞はoriginである肝細胞と同様に上皮性細胞の特性を良く保持するのに対し、非転移株Li7NM細胞はビメンチンをも共発現し、またE-カドヘリンの発現を失っている。これは上皮性腫瘍細胞が"epithelial-mesenchymal transition"(EMT)を起こして、間葉系細胞様の形質を獲得したものと考えられる。 EMTは、胎児の発達において非常に重要な過程であるばかりでなく、ある種の癌のプログレッション過程においてもしばしば認められる。一般にEMTを起こした、ないしはE-カドヘリン機能が低下・消失した腫瘍細胞は、その浸潤・転移性を増すと考えられており、今回の結果と矛盾するように思われるが、"腫瘍細胞が肝内で2次腫瘍を形成する段階においては、逆にE-カドヘリンを発現していることが有利に働く"という仮説が考えられる。 そこで、非転移株に遺伝子導入によりE-カドヘリンを発現させたところ、脾注後肝転移能を獲得し、肝注後の肝腫瘍形成能をも生じた。それら腫瘍組織内にて導入されたE-カドヘリンが安定に発現していることが確認され、E-カドヘリンの発現が肝(内)転移、特に肝における二次腫瘍形成に関わっていることが示唆された。 E-カドヘリンが分子レベルで如何にこの転移腫瘍形成に関与するかは、in vitroのアッセイで転移の結果に対応する一定の傾向が見られなかったため明らかではないが、この分子が腫瘍細胞同士の、ないしは腫瘍細胞と肝細胞との接着に関与する可能性、またはその発現が肝における増殖に有利である可能性などが考えられる。 今回の検討で用いた脾注モデルは腫瘍細胞の原発巣からの解離のステップを含んでおらず、E-カドヘリンの発現が肝内転移の過程全般に有利であるとは結論できない。現在までの様々な報告によれば、原発巣でのカドヘリンシステムの機能低下が浸潤・転移に促進性に作用することが考えられる。これらのことから、肝(内)転移の過程において原発巣におけるE-カドヘリンシステムを一過性に抑制する何らかの機構の存在が示唆され、その解明が今後の課題であろう。 [まとめ] 1)高転移株(Li7HM)と非転移株(Li7NM)との細胞構成蛋白の比較から、非転移株がepithelial-mesenchymal transitionをおこした亜株(ビメンチン発現、E-カドヘリン消失)と考えられるのに対し、高転移株はサイトケラチン8とE-カドヘリンを強く発現し、正常肝細胞同様の上皮性形質を良く保持することが示された。マウス肝細胞及び肝類洞内皮細胞に対する接着性は、高転移株で有意に高く、この系での転移性に関与している可能性が示唆された。 2)非転移株にE-カドヘリンを発現させると肝転移能及び肝における腫瘍形成能を獲得した。in vitroでは肝細胞monolayerへの浸潤の亢進が認められた。E-カドヘリンの発現が腫瘍細胞の肝における2次腫瘍形成に有利に働くことが示された。 [結語] 肝癌細胞におけるE-カドヘリンの発現が、その肝内転移巣形成に促進的に働く可能性が示唆された。 |