本研究は、このキネシン・モーター分子がATPを加水分解して得られたエネルギーを、どのように力学的なエネルギーに変えるのかを明らかにすることを目的として、電子顕微鏡によって、そのレールである微小管との相互作用を構造の面から解析を試みたものであり、下記の結果を得ている。 I.キネシンのモータードメイン(頭部)を大腸菌によって大量発現した。このキネシン頭部が微小管の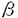 チュブリンにのみ結合するという性質を利用して、微小管の チュブリンにのみ結合するという性質を利用して、微小管の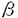 チュブリンの配列を急速凍結ディープエッチ法で観察した。これにより、長年予想はされていたものの、実際に存在が確かではなかった、微小管上のシームライン(継ぎ目)の存在を明らかにした。この結果は、キネシン頭部が微小管のプロトフィラメント1本に結合していることを示唆するものである。 チュブリンの配列を急速凍結ディープエッチ法で観察した。これにより、長年予想はされていたものの、実際に存在が確かではなかった、微小管上のシームライン(継ぎ目)の存在を明らかにした。この結果は、キネシン頭部が微小管のプロトフィラメント1本に結合していることを示唆するものである。 II.また、このシームラインは、試験管内で再構成された微小管のみに存在するのではなく、生体内の微小管にも存在することを、キネシン頭部を小脳の微小管に結合させることで明らかにしている。 III.このシームラインがあることによってキネシン頭部-微小管複合体の3次元の構造がらせん対称性を使って解析できないことが明らかとなった。これに対し、第2部では、微小管の多形性を利用し、通常の13pfの微小管を使わず、10pfの微小管を使うことで、らせん対称性を使った画像解析の手法を使用可能にしている。キネシン-微小管複合体のクライオ電子顕微鏡で取った写真を、らせん対称性を使って画像解析した結果、キネシン頭部は、プロトフィラメントの1本1本に結合していた。キネシンは微小管プロトフィラメントの土手の部分に結合しており、そこがキネシンの通り道になっていることを示唆している。 IV.第3部では、この手法を応用して、AMP-PNP,ADP+フッ化アルミニウム、ADP+りん酸、ADPの4種類のヌクレオチド存在下におけるキネシンの構造を観察している。前2者と、後2者がそれぞれ、strong binding,weak bindingに相当するのに合致して、大きく異なった構造であることが観察された。 以上、本論文は1.微小管の構造、2.キネシンモータードメイン-微小管複合体の構造、3.ヌクレオチド存在下のキネシンモータードメイン-微小管複合体の構造変化、という一連の流れによって、クライオ電子顕微鏡による構造面からの解析の基礎を築いたものである。これにより、本研究はキネシンのモーター活性の仕組みの解明に非常に重要な貢献をしており、学位の授与に値するものである。 |