サイクロフィリンは、1984年に免疫抑制剤サイクロスポリンA(CsA)の結合蛋白質として同定された蛋白質であり、ペプチド中のプロリン残基のシスートランス転換反応を触媒するペプチジルプロリル-シストランス-イソメラーゼ(PPIase)活性を持つことが示されている。また、ホモログが哺乳類のみならず、植物や細菌に至る生物界全般から見いだされ、進化上の保存性が極めて高いことが明らかになっている。さらに、サイクロフィリンはファミリーをなし、本研究で解析したサイクロフィリン40を含め、ヒトではこれまでに10のメンバーのcDNAが同定されている。 FKBP(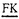 506 506  inding inding  rotein)はもう一つの代表的免疫抑制剤であるFK506の特異的結合因子として発見された蛋白質ファミリーで、これまでにヒトで7メンバーが同定されている。これらもPPIase活性を有し、やはり細菌から哺乳類まで存在する等、進化的保存性が高い。 rotein)はもう一つの代表的免疫抑制剤であるFK506の特異的結合因子として発見された蛋白質ファミリーで、これまでにヒトで7メンバーが同定されている。これらもPPIase活性を有し、やはり細菌から哺乳類まで存在する等、進化的保存性が高い。 イムノフィリンと総称されるこれら蛋白質群の免疫抑制反応における役割は詳しく解明されたが、生理的機能はほとんどわかっていない。しかし、PPIase活性があることから、蛋白質のフォールディングへの関与が考えられている。 最近、熱ショック蛋白質等、蛋白質のコンフォメーション形成・維持に関わる因子が、真核生物一般のシグナル伝達の調節に重要な役割を担っていることが明らかになってきている。イムノフィリンについても、あるものは非活性型ステロイド受容複合体の構成因子として見いだされており、ステロイドホルモンとの結合過程、あるいは結合によってレセプターが転写活性化に適した構造に変化する過程でレセプターに作用することにより、ホルモンのシグナル伝達に関与している可能性が示唆されている。 これらは非常に進化的保存性の高い蛋白質であるだけに、生物にとって根本的な機能を担っていると考えられ、種々アプローチでの解析は非常に重要である。また、CsAおよびFK506は、臓器移植等に不可欠の免疫抑制剤として広く使用されているが、副作用も多い。このメカニズムを明らかにし、よりよい免疫抑制剤を開発するためにも、イムノフィリンの解析は重要である。 本研究では、ヒトの新規なサイクロフィリンとしてサイクロフィリン40のcDNAを単離した。そして、生物界全般で重要と思われるその機能の解明に資すべく、遺伝子の単離、構造解析、および全塩基配列決定等の分子遺伝学的解析を行った。また、特異的結合蛋白質の単離・同定、特異的抗体の取得とそれを用いた生化学的な解析についても行った。 1.cDNAクローンの単離と解析 ヒト胎児脳cDNAライブラリーのスクリーニング過程で、新規なヒトのサイクロフィリン(サイクロフィリン40)cDNAを見いだし、370アミノ酸残基のオープンリーディングフレームを有する全長クローンを単離した。塩基配列解析の結果、そのN末側部分はサイクロフィリンAと非常に相同性が高く、一方、C末側部分はテトラトリコペプチドリピート(TPR)配列を有し、FKBPの一つで、ステロイドホルモン受容複合体の構成成分であるFKBP59のC末部分との相同性を有することが明らかになった。サイクロフィリン領域をヒトの他のサイクロフィリンと比較すると、植物のサイクロフィリンで保存されているアミノ酸配列GKPLHを含む8アミノ酸が存在すること、PPIase活性のCsA感受性に必要で、多くのメンバーで保存されているトリプトファン残基がヒスチジンである点が異なっていた。実際、大腸菌で発現させたヒト・サイクロフィリン40の組換え体はPPIase活性を保持していたが、そのCsA感受性はヒト・サイクロフィリンAより約10倍低かった。ノザンブロット解析の結果、この遺伝子はヒトの多くの組織で普遍的に発現していることが示された。 2.ヒト・サイクロフィリン40遺伝子の単離と解析 このサイクロフィリンの遺伝学的側面からの解析の基盤とすべく、遺伝子の取得を試みた。cDNAをプローブとして、ヒトのゲノムライブラリーをスクリーニングし、サイクロフィリン40遺伝子を含む組換えファージを3クローン単離した。これらを用いて遺伝子の物理的構造を解析し、次いで全遺伝子とプロモーター部分を含む17.1kbの塩基配列を決定した。この遺伝子は14.2kbにおよび、10のエキソンからなっていた。エキソンの大きさは最小43塩基対、最大698塩基対であり、イントロンとの接合部分の配列は全てGT/AT則に従っていた。同じファミリーに属し、アミノ酸配列の相同性が非常に高いサイクロフィリンAおよびNK-TR遺伝子とエキソン構成を比較したが、いずれとも共通点はなく、進化上非常に早期の重複多様化が示唆された。遺伝子内あるいは近傍に計10ヶのAlu反復配列を、また5’上流域には21ユニットのGTリピートを同定した。これら多型を生じやすい配列は、連鎖解析などの遺伝学的解析に有用である。アンカーライゲーションPCR(5’RACE法)にてmRNAの5’端を決定したところ、転写は翻訳開始点の約80bp上流を中心に複数の位置から開始されていた。これに加え、遺伝子の5’近傍領域はTATAおよびCAATボックスを持たず、GC配列に富み、複数のSp1配列を有するという、ハウスキーピング遺伝子に特徴的なもので、ノザンブロット解析の結果と一致した。Ap1等の種々転写因子の結合配列もいくつか見いだされた。齧歯類-ヒト・ハイブリッド細胞のDNAを用いたPCR解析により、この遺伝子は第4染色体にマップされた。ヒト・サイクロフィリン40cDNAをプローブにして、他のサイクロフィリンメンバーが検出されない条件で各種生物のDNAとのハイブリダイゼーションを行ったところ、脊椎動物のみならず、軟体動物、節足動物DNAからもホモログ配列が検出され、この遺伝子の進化上高度の保存が示唆された。 3.サイクロフィリン40遺伝子産物の解析 ヒト・サイクロフィリン40のC末側を抗原とするモノクローナル抗体を作製した。この抗体を用いた免疫染色により細胞内局在性を検討したところ、サイクロフィリン40は、核に比べ、細胞質により多く存在することが示された。ウェスタンブロット解析では、酵母中に交叉反応をする蛋白質(45kDa)が認められ、このことからもサイクロフィリン40の進化上の高度な保存が示唆された。サイクロフィリン40の1次構造からは、その生理的機能の推定は困難であった。また、サイクロフィリン40をFKBP59と同様にステロイドホルモン受容複合体中から単離した報告もあったが、詳細は明らかでなかった。そこで、サイクロフィリン40の生理機能解明の端緒となる、その結合蛋白質の同定を試みた。大腸菌にてヒト・サイクロフィリン40をヒスチジンタグとの付加体として調製し、それを付着させたアフィニティーレジンを用いて、ウサギ網状赤血球抽出液よりサイクロフィリン40の結合蛋白質を単離した。90kDaのこの蛋白質は、特異的抗体との反応性からhsp90と同定された。精製ヒトhsp90を用いた結合実験でも、サイクロフィリン40との結合が示された。CsAや、hsp90に特異的に結合する免疫抑制剤デオキシスパガリン、あるいはhsp90とv-srcとの結合を阻害するハービマイシンAは、サイクロフィリン40とhsp90の結合になんら影響しなかった。次に、サイクロフィリン40の欠損蛋白質を用いた解析から、結合に関与する領域の同定を試みた。N末側半分部分のみでは結合しなかったが、C末側半分部分では結合し、TPR配列を含むこの部分が、hsp90との結合に必要十分な領域であることが示された。 4.結論 1)ヒトcDNAライブラリーより、新規なサイクロフィリン(サイクロフィリン40)のcDNAを単離した。このサイクロフィリンはC末側のアミノ酸配列が、FK506結合蛋白質であるFKBP59との相同性を有するというユニークな構造を有していた。 2)ヒトゲノムライブラリーより、サイクロフィリン40遺伝子を単離し、その周辺部を含む全塩基配列を決定した。遺伝子は全長14.2kbに及び、10のエキソンよりなっていた。また発現調節領域について、転写開始位置が多数存在し、その周辺の塩基配列にはTATAボックスがなくGC配列に富む等、ハウスキーピング遺伝子を示す諸性質を明らかにした。さらに、Alu、GT反復配列等、遺伝解析に有用な配列を同定した。 3)サイクロフィリン40は細胞質により多く存在することを明らかにした。 4)サイクロフィリン40の機能解明に重要なその結合蛋白質を単離し、hsp90と同定した。その結合には、サイクロフィリン40のC末側が必要十分であることを明らかにした。 5)サザンブロット解析において節足動物や軟体動物のDNAからもサイクロフィリン40のホモログ配列を見いだし、また、酵母中に抗ヒト・サイクロフィリン40抗体に反応する蛋白質を検出した。さらに、遺伝子の塩基配列解析により、そのエキソン構成はサイクロフィリンファミリーの他のメンバーと全く共通点がないことを明らかにした。これらのことから、このサイクロフィリンが進化上非常に早期にファミリーの他メンバーと重複多様化し、その後高度に配列が保存されてきた可能性が高いことを示した。 以上の諸性質より、新規なサイクロフィリン、サイクロフィリン40は、進化上非常に早期から存在した、生物にとって基本的な機能を担う因子である可能性が高い。本研究での解析結果は、この重要な因子の今後の機能解明の基盤となると考えられる。 |