| はじめに ヘミブレベトキシンB(1)は1989年に清水らによりメキシコ湾やフロリダ沿岸に生息する渦鞭毛藻Gymnodinium breveから単離構造決定された海洋産ポリエーテル系天然物の一つである。その化学構造は、10個の不斉炭素と側鎖に(Z)-ジエン部と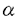 -ビニルアルデヒド構造を持つ特異な四環性6,6,7,7-環状エーテル骨格を有している。この様にヘミブレベトキシンB(1)は特異な多環状エーテル構造をもち、かつ神経毒性や細胞毒性などの顕著な生物活性を有している事から、近年その合成研究が活発に行われている。 -ビニルアルデヒド構造を持つ特異な四環性6,6,7,7-環状エーテル骨格を有している。この様にヘミブレベトキシンB(1)は特異な多環状エーテル構造をもち、かつ神経毒性や細胞毒性などの顕著な生物活性を有している事から、近年その合成研究が活発に行われている。 今回著者は、海洋産ポリエーテル系天然物の合成研究の一環として、ヘミブレベトキシンB(1)の合成を目指して研究を行い、ダブル転位-環拡大反応によるCD環の構築、ヒドロキシスチリルエポキシドのエンド環化反応によるB環の構築、A環アセタールへの側鎖4炭素の一段階導入など、著者の開発した合成手法を基盤として、その立体選択的全合成を達成した。  ヘミブレベトキシンBのCD環構築の検討 最近、中田らは彼らの開発した転位-環拡大反応を基盤としてヘミブレベトキシンB(1)のCD環部分の合成に成功している。しかし、その収率は必ずしも満足出来るものではなかった。そこで著者は、この転位-環拡大反応の再検討を行い、基質にビスクロロメタンスルホネート2を用いることによって、これまでに比べより温和な条件で、目的の環拡大された7,7-環状エーテル3を高収率で得ることが出来た。  ヒドロキシスチリルエポキシドの6-エンド環化によるB環構築の検討 B環構築のために、Nicolaouの開発したヒドロキシビニルエポキシドのエンド環化反応を、モデル化合物4a(R=H)を用いて検討した。しかしながら、目的とする6-エンド環化体5aを選択性良く得ることは出来なかった(5a:6a=1:1)。  著者は、ビニル基の代わりにスチリル基を用いれば選択性の向上が期待出来ると考え、まず最初に、鎖状化合物による環化反応でスチリル基の効果を検討した。 その結果、4種のヒドロキシスチリルエポキシド7a-dに対し、酸性条件下環化反応を行ったところ、いずれも5-エキソ体8は全く得らず、目的とする6-エンド体9-12のみが生成した。従って、本反応はピラン環及びオキセパン環を有する天然物合成に有効な手段となると考えられる。  本反応をモデル化合物4b(R=Ph)に応用し、PPTSで環化を行ったところ、目的のトランス-6-エンド環化体5bのみを選択的に得ることが出来た。 モデル化合物によるA環部の立体選択的合成 2環性化合物アセテート13にZnCl2存在下アリルマグネシウムクロリドを反応させると、望む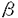 -アルコール14を収率良く得ることが出来た(14:15=1.8:1)。 -アルコール14を収率良く得ることが出来た(14:15=1.8:1)。  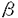 -アルコール14をオゾン酸化しラクトール16に変換後、MeCN中TMSOTf存在下TMSCH2C(=CH2)CH2OAcを用いてC-グリコシル化を行い、4炭素が一挙に導入された17のみを立体選択的に得ることが出来た。さらに、17からヘミブレベトキシンB(1)と同様のAB環及び側鎖を有する19を合成した。また、 -アルコール14をオゾン酸化しラクトール16に変換後、MeCN中TMSOTf存在下TMSCH2C(=CH2)CH2OAcを用いてC-グリコシル化を行い、4炭素が一挙に導入された17のみを立体選択的に得ることが出来た。さらに、17からヘミブレベトキシンB(1)と同様のAB環及び側鎖を有する19を合成した。また、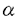 -アルコール15からも水酸基の反転を経て、18を立体選択的に得た。 -アルコール15からも水酸基の反転を経て、18を立体選択的に得た。  ヘミブレベトキシンBの全合成 既に中田らは転位反応の基質となったジオール22を既知化合物21より合成している。今回著者も、その方法に準じて反応条件の最適化をはかりつつジオール22を合成した。  ジオール22よりビスクロロメタンスルホネート2を得、前述の様にダブル転位-環拡大反応により7,7-環状エーテル3を合成した。さらに3の1級水酸基をトシル化した後、シアノ化し23を得た。側鎖オレフィン部をオスミウム酸化でジオールとし、アセトナイドで保護した後、シアノ基をDIBAH還元しアルデヒドを得た。これをWittig反応によって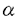 , ,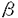 -不飽和エステルとした後、2つの3級水酸基をTMS基で保護し24を合成した。24をDIBAH還元後、D-(-)-DETを用いるSharplessの不斉エポキシ化反応を行いエポキシアルコールとし、さらにTPAP-NMO酸化でアルデヒドとした後、Wittig反応でスチリル基を導入し25を得た。25のTMS基を除去した後、CSAで処理することにより6-エンド環化体26のみを得、立体選択的にB環を構築することが出来た。 -不飽和エステルとした後、2つの3級水酸基をTMS基で保護し24を合成した。24をDIBAH還元後、D-(-)-DETを用いるSharplessの不斉エポキシ化反応を行いエポキシアルコールとし、さらにTPAP-NMO酸化でアルデヒドとした後、Wittig反応でスチリル基を導入し25を得た。25のTMS基を除去した後、CSAで処理することにより6-エンド環化体26のみを得、立体選択的にB環を構築することが出来た。  さらに、26の2級水酸基をアセチル化後、3級水酸基をTBS基で保護し27を得た。27のスチリル基をオゾン酸化でアルデヒドとした後、直ちにアリルマグネシウムクロリドと反応させ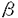 -アルコール28及び -アルコール28及び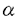 -アルコール29を得た(28:29=2:1)。 -アルコール29を得た(28:29=2:1)。  まず、望む立体化学を有する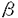 -アルコール28を用いてA環構築を行った。28をオゾン酸化の後、直ちにメタノール中DOWEXで処理し、アセタール化と同時にアセトナイドの脱保護を行いジオールを得た。ついで、過ヨウ素酸酸化でアルデヒドに導き、Wittig反応の後、過酸化水素で処理しジエン30を合成した。30にMeCN中TMSOTf存在下TMSCH2C(=CH2)CH2OAcを作用させると、立体選択的C-グリコシル化が進行し31(R=TBS)及び32(R=H)が生成した。31はMeCN中TMSOTfで処理し32に変換できた。さらに -アルコール28を用いてA環構築を行った。28をオゾン酸化の後、直ちにメタノール中DOWEXで処理し、アセタール化と同時にアセトナイドの脱保護を行いジオールを得た。ついで、過ヨウ素酸酸化でアルデヒドに導き、Wittig反応の後、過酸化水素で処理しジエン30を合成した。30にMeCN中TMSOTf存在下TMSCH2C(=CH2)CH2OAcを作用させると、立体選択的C-グリコシル化が進行し31(R=TBS)及び32(R=H)が生成した。31はMeCN中TMSOTfで処理し32に変換できた。さらに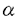 -アルコール29も水酸基の反転を経て31に導いた。32をMeOH中K2CO3で処理しトリオールに導き、最後に二酸化マンガンで酸化し -アルコール29も水酸基の反転を経て31に導いた。32をMeOH中K2CO3で処理しトリオールに導き、最後に二酸化マンガンで酸化し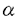 , ,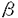 -不飽和アルデヒド1を得た。ここで得られたアルデヒド1の各種機器データは、天然のヘミブレベトキシンB(1)のデータと完全に一致した。 -不飽和アルデヒド1を得た。ここで得られたアルデヒド1の各種機器データは、天然のヘミブレベトキシンB(1)のデータと完全に一致した。  以上、クロロメタンスルホニルオキシ基を用いる転位-環拡大反応及び、ヒドロキシスチリルエポキシドのエンド選択的環化反応という、著者の開発した二種のエーテル環構築反応を基盤として、海洋産ポリエーテル系天然物の一つであるヘミブレベトキシンB(1)の全合成を達成することが出来た。 |