本研究は生体への遺伝子導入効率の高い組み換えアデノウイルスベクターを用いて、癌遺伝子治療に用いられる自殺遺伝子(HSV-tk)をCEA産生胃癌細胞に選択的に発現させ、HSV-tkによって活性化されるガンシクロビル(以下GCV)との組み合わせにより、癌選択的に殺細胞効果を得ることを目的として検討されたものであり、下記の結果を得ている。 1)CEA遺伝子の転写開始地点より約420塩基上流までの塩基配列はCEAプロモーター活性を持つことが知られている。CEAプロモーター活性の下流にレポーター遺伝子(lacZ)を含む組み換えアデノウイルスベクターを作成し、CEA産生及びCEA非産生の胃癌細胞を対象にlacZ遺伝子の導入実験を行った。lacZ遺伝子の発現はCEA産生胃癌に選択的に、かつCEA産生量に比例して高い効率で認められた。 2)HSV-tk導入癌細胞は低濃度のGCVで殺細胞されることから、CEAプロモーターの下流に自殺遺伝子(HSV-tk)を含む組み換えアデノウイルスベクターを作成し、胃癌細胞のGCV感受性をHSV-tk遺伝子導入前後で比較した。CEA産生胃癌細胞では50%細胞増殖抑制GCV濃度(IC50)がHSV-tk遺伝子遺伝子導入前のIC50>400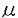 Mから導入後のIC50=5〜21 Mから導入後のIC50=5〜21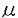 Mに約20倍感受性が上昇したが、CEA非産生癌細胞では遺伝子導入前後で変化しなかった。 Mに約20倍感受性が上昇したが、CEA非産生癌細胞では遺伝子導入前後で変化しなかった。 上記の結果からアデノウイルスベクターとCEAプロモーターによって高い効率で癌選択的な遺伝子導入が可能であり、さらにHSV-tkとGCVの組み合わせにより、in vitroで癌選択的殺細胞効果を得ることができた。 3)CEAプロモーターとHSV-tk遺伝子を含むアデノウイルスベクターとGCVによる殺細胞効果が遺伝子導入されない細胞にも波及するか検討するため、HSV-tk遺伝子導入したCEA産生胃癌と非導入細胞を混合しin vitro,in vivoでGCV存在下に増殖を観察した。細胞増殖はHSV-tk導入細胞を各20%、50%混合した場合、非導入細胞の細胞増殖に比べ、各40%、10%に抑制され、明らかなbystander効果が認められた。 4)ヌードマウス皮下に移植したCEA産生胃癌腫瘍にアデノウイルスベクター直接注入して、HSVtk発現を免疫組織染色で検討したが、およそ30-40%腫瘍細胞に強いHSVtk発現を認め、腫瘍細胞以外では発現されなかった。 またこの皮下腫瘍体積は移植後35日目には、無治療群で400mm3以上に増大するのに対し、アデノウイルスベクター直接注入とGCV投与による治療群では腫瘍体積は150mm3程度と約1/3に抑制され、腫瘍組織は広範な壊死に陥っていた。 以上、本論文はCEAプロモーターを含むアデノウイルスベクターを用いて胃癌選択的に自殺遺伝子を導入が可能であり、自殺遺伝子導入とガンシクロビルと組み合わせることでCEA産生胃癌細胞に十分な殺細胞効果をもたらすことを明らかにした。本研究は、アデノウイルスベクターで導入された遺伝子を癌特異的に発現することを可能にしたことから、胃癌をはじめCEA産生癌に対する遺伝子治療の研究開発上、重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |