学位論文要旨
| No | 213584 | |
| 著者(漢字) | 野口,修治 | |
| 著者(英字) | ||
| 著者(カナ) | ノクチ,シュウジ | |
| 標題(和) | Ustilago sphaerogena由来リボ核酸分解酵素RNase U2の立体構造X線結晶構造解析による研究 | |
| 標題(洋) | ||
| 報告番号 | 213584 | |
| 報告番号 | 乙13584 | |
| 学位授与日 | 1997.11.12 | |
| 学位種別 | 論文博士 | |
| 学位種類 | 博士(薬学) | |
| 学位記番号 | 第13584号 | |
| 研究科 | ||
| 専攻 | ||
| 論文審査委員 | ||
| 内容要旨 | リボ核酸分解酵素RNase U2は、Ustilago sphaerogenaが産生する114アミノ酸残基からなるendoribonucleaseである。RNase U2は一本鎖RNAのプリン塩基、特にアデニンを特異的に認識し、ホスホジエステル結合を切断する。その酵素反応では、RNAのリボースO2’が塩基触媒にプロトンを渡してリン原子を求核的に攻撃し、リボースO5’が酸触媒からプロトンを受け取ってリン原子から脱離して2’,3’-環状ヌクレオチド中間体を生じ、次に、水分子がリン原子に求核的に付加し、リボースO2’が脱離してヌクレオチド3’-リン酸が生じると推定されている。本研究では、RNase U2の蛋白質立体化学的な特徴及び立体構造の多様性を明らかにし、酵素反応機構を解明するために、RNase U2のX線結晶構造解析を行った。 U.sphaerogenaの培養液から精製したRNase U2を蒸気拡散法により結晶化し、シンクロトロン放射光または銅K  RNase U2は直径約30Åの球状の蛋白質で、N末端側から2本鎖 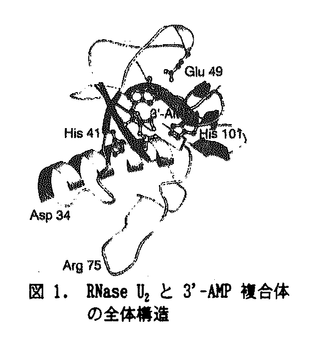 II型結晶ではAsp45がイソアスパラギン酸(isoAsp)に異性化していることを見いだした(図2)。これは結晶化の過程でアスパラギン酸がスクシンイミドを経て異性化したものと考えられる。isoAsp45主鎖部分は伸びきったコンフォメーションを示し、L-isoAsp-L-Alaの結晶構造とほぼ同じである。これは 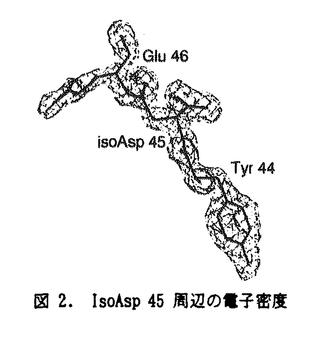 このようなアスパラギン酸の異性体がニワトリ卵白リゾチームにも存在することに着目し、その異性体を精製、結晶化して、構造解析を行った。その結果Asp101から生じたスクシンイミド体の立体構造を初めて得ることができた。スクシンイミドの近傍はtype I VIII型結晶では、酵素反応産物の3’-AMPはRNase U2分子の中央にある幅約9Åの溝状部に結合している(図3)。3’-AMPのリボースのパッカリングはC3’-endo、塩基はsynの配置である。アデニン塩基はTyr44、Glu49、Asp108に囲まれた領域に結合している。アデニン塩基にはTyr44主鎖のNとOがそれぞれアデニン塩基のN7とN6に、Glu49側鎖のO  RNase U2に結合した3’-AMPリン酸基の酸素原子のうち、O3Pは蛋白質分子の内部を向き、Glu62側鎖とArg85 このような触媒部位の構造から、次のような酵素反応機構が考えられる。まずリボースO2’がO1Pの反対側からリン原子に接近して求核的に攻撃する。このときリボースO2’からプロトンを受け取る塩基触媒の役割を果たす残基は、His41またはGlu62である。触媒部位の奥に位置するArg85は、RNase U2分子内部を向くO3Pと水素結合を形成してリン原子の求電子性を高め、リボースO2’によるリン原子への求核攻撃反応を促進する役割を果たす。リボースO2’がリン原子に付加して生じる三角両錐型の五配位リン原子遷移状態では、O1PはリボースO2’と共に両錐の頂上部を占め、O2PはO3P及びリボースO3’と共に平面三配位部を占める。次に、リン原子からリボースO5’が脱離し2’,3’-環状ヌクレオチドが生じるが、O1Pが脱離するヌクレオチドのリボースO5’に対応する場合は、His101が脱離するリボースO5’にプロトンを供給する酸触媒の役割を果たす。一方、O2Pが脱離するリボースO5’に対応するとした場合は、リン原子に結合した原子が偽回転を起こし、O2Pが五配位の両錘頂上部を占めてリン原子から脱離する。リボースO5’は偽回転前にTyr39 RNase U2はRNA切断反応時には、切断されるホスホジエステル結合O5’側の少なくとも2残基のヌクレオチドと相互作用する事が示唆されており、ヌクレオチドが結合するサブサイトが存在すると考えられる。VII型結晶での2’-AMPの結合位置は、切断されるホスホジエステル結合のO5’側1番目のヌクレオチドの結合サブサイトの位置を示していると考えている。2’-AMPのリン酸基は、3’-AMPのリン酸基とほぼ同じ位置に結合し、アデニン塩基はPro81からPro83の領域とHis101に囲まれた領域に結合してHis101のイミダゾール環と3.2Åの密な接触をしている。このサブサイトの位置は、触媒部位に関してリン酸基を求核攻撃するリボースO2’とは反対側にあり、リン原子からヌクレオチドが脱離するのに適している。 RNase U2の結晶構造を、アミノ酸配列の相同性が28%と低いRNase T1をモデル分子とした分子置換法により決定することができた。全体構造は イソアスパラギン酸を持つRNase U2とスクシンイミドをもつリゾチームの結晶構造を、アスパラギン酸が異性化している蛋白質の立体構造として初めて決定した。アスパラギン酸が異性化した蛋白質は加齢によって生体内に蓄積されるという報告があり、蛋白質におけるアスパラギン酸異性化と老化現象との関連が注目されているが、これらの結晶構造は蛋白質におけるアスパラギン酸の異性化反応を構造生物学的に解明するための基礎となり得る。 | |
| 審査要旨 | リボ核酸分解酵素ribonuclease(RNase)U2は,クロボキンUstilago sphaerogenaが産生するアミノ酸114残基からなるendoribonucleaseである。RNase U2は1本鎖RNAのプリン塩基,とくにアデニンを特異的に認識することからRNAの配列解析にも用いられている。その酵素反応の機構では,類縁のAspergillus oryzae由来RNase T1との類推から,2’,3’-環状ヌクレオチド中間体を経てRNAを水解切断するものと推定されているが,これら酵素の認識機構と反応機構の構造的な知見は未だ十分には得られていない。本論文は,RNase U2の三次元構造上の特徴と多様性,基質認識と酵素反応の機構の解明を目的としたX線結晶構造解析による研究を述べたものである。 研究では,シンクロトロン放射光と銅K RNase U2分子は直径約30Åの球状であり,N末端側から2本鎖 II型結晶では,報告されていたアミノ酸配列の誤りと,Asp45がイソアスパラギン酸(isoAsp)に異性化して 研究では,アスパラギン酸の異性化がニワトリ卵白リゾチームにも生ずることに着目し,異性体蛋白質を精製し,X線結晶構造解析を行った。その結果,Asp101から生じたイソアスパラギン酸体,環状のスクシンイミド中間体の双方の三次元構造を得ることに成功した。アスパラギン酸が異性化した蛋白質が加齢とともに生体内に蓄積されていくとの報告が増えつつおり,本研究は異性化反応の構造的な理解を初めて与えるものである。 VIII型結晶では,RNase U2分子の中央の幅約9Åの溝状部に酵素反応産物のアデノシン3’-リン酸(3’-AMP)が結合しており,そのアデニン塩基はTyr44,Glu49とAsp108に囲まれた領域に位置し,Tyr44主鎖のNとOがそれぞれ塩基のN7とN6に,Glu49側鎖の 結合した3’-AMPのリン酸基の酸素原子はTyr39,Glu62,Arg85,His101,および水分子549と水素結合を形成している。His41 RNA切断反応時には,切断されるO5’側の少なくとも2残基のヌクレオチドが結合するサブサイトの存在が考えられる。VII型結晶でのアデノシン2’-リン酸(2’-AMP)のリン酸基は触媒部位,塩基はPro81からPro83にかけてとHis101に囲まれた領域に位置している。この領域を1番目のヌクレオチドが結合するサブサイトに帰着することにより,サブサイトへの結合がヌクレオチドの脱離を促進するという知見をよく説明できた。 本論文は,RNase U2の構造と機能の理解に必須とされる詳細な三次元構造の知見を与え,また,蛋白質中のアスパラギン酸が環状スクシンイミドを経て | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/54039 |
 線を用いてX線回折強度を収集した。IIからVII型の7種の結晶型のうち、まずII型結晶について、RNase U2とのアミノ酸の一致度が28%のAspergillus oryzae由来のRNase T1をモデル分子とした分子置換法により初期構造を求め、分子モデル構築と結晶学的構造精密化を行った。III、IV、V、VI、VII、及びVIII型の各結晶の構造はII型結晶の構造を用いる分子置換法により決定し、結晶学的構造精密化を行った(表1)。II、III型結晶では硫酸イオンが、VII型結晶では阻害剤のアデノシン2’-リン酸(2’-AMP)とCa2+が、VIII型結晶では酵素反応産物のアデノシン3’-リン酸(3’-AMP)が蛋白質分子に結合している。
線を用いてX線回折強度を収集した。IIからVII型の7種の結晶型のうち、まずII型結晶について、RNase U2とのアミノ酸の一致度が28%のAspergillus oryzae由来のRNase T1をモデル分子とした分子置換法により初期構造を求め、分子モデル構築と結晶学的構造精密化を行った。III、IV、V、VI、VII、及びVIII型の各結晶の構造はII型結晶の構造を用いる分子置換法により決定し、結晶学的構造精密化を行った(表1)。II、III型結晶では硫酸イオンが、VII型結晶では阻害剤のアデノシン2’-リン酸(2’-AMP)とCa2+が、VIII型結晶では酵素反応産物のアデノシン3’-リン酸(3’-AMP)が蛋白質分子に結合している。 シート、4.4回転の
シート、4.4回転の とO
とO がアデニン塩基のN6とN1に水素結合しており、これらの残基がアデニンの特異的認識を担っている。310ヘリックスを挟んで配置するTyr44主鎖とGlu49側鎖から成る塩基認識部位の構造は、RNase T1などの微生物由来の類似のRNaseには存在せず、アデニン塩基の認識に特徴的なものと考えられる。
がアデニン塩基のN6とN1に水素結合しており、これらの残基がアデニンの特異的認識を担っている。310ヘリックスを挟んで配置するTyr44主鎖とGlu49側鎖から成る塩基認識部位の構造は、RNase T1などの微生物由来の類似のRNaseには存在せず、アデニン塩基の認識に特徴的なものと考えられる。 に水素結合しでいる。O1PとO2Pは溶媒領域に面してWat549に水素結合しており、またTyr39O
に水素結合しでいる。O1PとO2Pは溶媒領域に面してWat549に水素結合しており、またTyr39O がO2Pに、His101
がO2Pに、His101 がO1Pに水素結合している。リボース部分ではHis41
がO1Pに水素結合している。リボース部分ではHis41 とリボースO2’間に水素結合が形成され、リボースO2’はリン原子に関してO1Pと反対側に位置している。この3’-AMPの結合様式では、リボースO5’及びリン酸基のO1PまたはO2PのまわりにRNA鎖が連なり得る空間が存在しており、基質のRNAもこの結合様式をとり得ることを示している。
とリボースO2’間に水素結合が形成され、リボースO2’はリン原子に関してO1Pと反対側に位置している。この3’-AMPの結合様式では、リボースO5’及びリン酸基のO1PまたはO2PのまわりにRNA鎖が連なり得る空間が存在しており、基質のRNAもこの結合様式をとり得ることを示している。