| 1.はじめに 癌のような疾患に対して治療効果を比較する無作為化臨床試験においては、いくつかの施設が共同で臨床試験を管理・運営していく多施設臨床試験が行われる。多施設臨床試験を行う最大の理由は、短期間の患者蓄積のためと施設選択に関する結論の一般化可能性検討のためである。臨床試験、特に標準治療の構築と普及を目指す第III相臨床試験計画の目標は、精確性(clarity)、比較可能性(comparability)、一般化可能性(generalizability)の3つにまとめることができる。精確性の要求とは、ランダム誤差を小さくし、研究の精度を向上させることである。比較可能性の要求とはバイアスを減らすことに対応し、研究の正確性を向上させることである。我が国の多施設臨床試験は、施設当たりの患者数が極端に少なく、参加施設数は非常に多いという特徴をもち、バイアスの点で問題があるとしばしば指摘を受ける。しかしながら、ランダム化が施設内で適切に行われていれば、即ち治療群間の比較可能性が保証されている限り、患者選択に関するバイアスは発生せず、治療群間の比較の統計的推測は妥当である。問題はバイアスを含み得る対象集団、施設から得られた結論の一般化可能性である。 通常の臨床研究においては、研究成果を適用する目標集団と実際に研究が行われる対象集団の間には数のうえでも質のうえでも大きな隔たりが生じる可能性が存在する。したがって、厳密にいえば、無作為化臨床試験から得られる結論の適用範囲は当該の対象集団のみであり、この結論が目標集団まで外挿できるかどうかが一般化可能性の議論である。観察された治療効果の差が施設間で一様であれば、即ち治療効果に関する施設間差が小さければ、得られた結論の施設選択に関する一般化可能性は高いと推察される。逆に、大きな施設間差が存在した場合にはその原因を積極的に探索することにより、重要な知見が得られ、臨床試験の質管理に貢献できる。 施設間差とは、施設、対象者に関わる明示的に表現可能な要因のみならず、医師の診断、治療、管理、評価法など明示的表現が困難な要因をもすべて含めた施設間の違いを表す。本論文では、施設間差を施設が元々もっているベースライン時でのリスクの違い(ベースライン施設間差)と治療効果の違い(治療効果の施設間差)の2つにわけて考える。 本論文の目的は次の2つである。 1.ベースライン、及び治療効果に関する施設間差をモデル化するために、ベイズ的階層生存時間モデル(Bayesian hierarchical survival model)を提案する。その事後分布の計算には複雑な統計モデルに対する数値的アプローチであるGibbs samplingによる方法を提案する。 2.提案する方法論を胃癌治癒切除後の免疫化学療法の多施設臨床試験データに応用する。 2.ベイズ的階層生存時間モデル 癌生存時間解析において標準的に用いられる比例ハザードモデルに施設間差を表すパラメータを加えた次式のようなモデルを提案する。   ijは施設間差パラメータを与えた下でのi番目の施設(i=1,…,N)のj番目の患者(j=1,…,ni)のハザード関数、 ijは施設間差パラメータを与えた下でのi番目の施設(i=1,…,N)のj番目の患者(j=1,…,ni)のハザード関数、 0(t)はベースラインハザード関数である。 0(t)はベースラインハザード関数である。 k(k=1,…,p)は共変量xijkに対する固定効果パラメータで、xij1が治療群を表す指示変数である。bi0とbi1はそれぞれベースラインハザード、および平均的な治療効果 k(k=1,…,p)は共変量xijkに対する固定効果パラメータで、xij1が治療群を表す指示変数である。bi0とbi1はそれぞれベースラインハザード、および平均的な治療効果 1からのi番目の施設のズレを表す施設間差パラメータである。 1からのi番目の施設のズレを表す施設間差パラメータである。 通常の癌臨床試験では施設当たりの患者数は少なく、施設数は非常に多いため、各施設のパラメータの精度の高い推定を行うことは不可能である。そこで、施設毎のパラメータが互いに独立に、ある確率分布に従うと仮定するベイズ的アプローチを考える。ここでは、ベースライン、および治療効果に関する施設間差を表すパラメータが互いに独立に平均ゼロ、分散 の正規分布に従うと仮定する。このモデルは、経時観察データのような相関のある反応変数に対するモデリングアプローチの一つである混合効果モデルを、打ち切りを伴う生存時間データの場合に拡張したものと捉えることができる。 の正規分布に従うと仮定する。このモデルは、経時観察データのような相関のある反応変数に対するモデリングアプローチの一つである混合効果モデルを、打ち切りを伴う生存時間データの場合に拡張したものと捉えることができる。 3.結果 胃癌治癒切除後の免疫化学療法の有効性を検討した多施設臨床試験データ(SIP研究)に、ベイズ的階層生存時間モデルを応用した結果を示す。この研究は、胃癌術後の標準的な補助化学療法を行う群(標準治療群)と標準治療に加えてPSKと呼ばれる免疫療法も行う群(新治療群)の2群間比較の無作為化臨床試験であり、関心のあるエンドポイントは死亡までの生存時間である。患者登録期間は1985年7月から1987年6月までの2年間で、1992年6月末まで追跡を行った。解析対象者数は253人で、参加施設は46施設である(平均5.6人/施設、範囲1-14人)。 ここでは、施設内の患者数が2人以上の施設(少なくとも1人はどちらかの治療群に割り付けられている)を解析対象とした。その結果、36施設が解析対象となり、1施設あたりの平均患者数は6.7人(標準偏差3.3)であった。治療群間に生じた病理学的ステージ(pTNM)のアンバランスを調整するため、pTNM分類を共変量としたモデルを考えた。 提案したモデルを当てはめた結果、治療効果に関するハザード比の事後分布は平均が0.65、その90%確率区間が0.39-1.01であった。 図1に施設毎のベースラインリスクに関する結果を示す。横軸が個々の施設で1番から36番目の施設まで存在し、縦軸がベースライン施設間差の事後分布を箱ヒゲ図の形で表現している。この図から、事前平均の1よりもベースラインリスクが高い(何らかの理由でその施設が元々もっている死亡リスクが大きい)施設や、逆に、ベースラインリスクが事前平均よりも低い施設もいくつか存在しており、ベースラインリスクに関しては質的な施設間差が存在することがわかる。  図1: ベースラインに関する施設間差 図1: ベースラインに関する施設間差 図2に施設毎の治療効果に関する結果を示す。縦軸は各施設のハザード比の事後分布である。この図から、多少のバラツキは存在するが、施設間で治療効果の大きさはほぼ一様で、いずれの施設の結果もハザード比が1より小さい方向を向いていることがわかる。 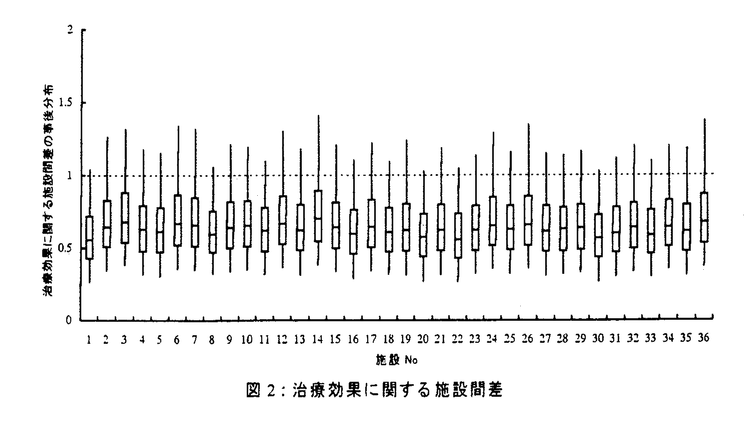 図2: 治療効果に関する施設間差 図2: 治療効果に関する施設間差 つまり、ベースラインリスクに関しては施設間で大きな違いが観察されたものの、施設毎の治療成績は大きく異ならないことが確認されたといえる。 4.考察 死亡や再発などのイベント発生、あるいは打ち切りまでの時間をエンドポイントとする多施設臨床試験データに対して、ベースライン、及び治療効果の2つの施設間差を考慮したモデルを提案した。事後分布の計算にはcomputer intensive methodであるGibbs samplingを用いることを提案した。これらの方法論を胃癌治癒切除後の免疫化学療法の多施設臨床試験データに応用した結果、ベースラインリスクに関しては大きな施設間差が観察されたものの、治療効果に関しては質的にその効果は変わらないことが確認された。したがって、このデータの場合、治療効果に関する施設間差は小さく、今回観察された治療効果に関する結論の一般化可能性は高いと推察された。 ステージの影響を調整した後でもベースラインリスクに関して施設間で大きなバラツキが観察された原因を探るため、SIP研究に参加した3人の専門家に今回の解析対象である36施設の評価(A(good)、B(fair)、C(poor)の3段階)を依頼した。その専門家の意見と施設毎のベースラインリスクの推定結果(図1の各施設のメディアン)との相関を検討した結果、ベースラインリスクの推定結果が小さい、つまり何らかの理由でベースラインでの死亡リスクが小さい施設ほど、Aと評価される割合が高く、一方、ベースラインリスクの推定結果が大きい施設ほど、Cと評価される傾向が存在することが示された。施設間差をモデル化するために用いた今回の方法論の結果が、参加施設を熟知している専門家の主観的な印象と一致していたことを示唆しているといえる。 今回提案したベイズ的階層生存時間モデルを評価する別のアプローチとして、各施設での手術時の肉眼診断の正確さとベースラインリスクの相関を検討した。診断の正確さは各患者のステージの肉眼診断と病理診断の不一致度で、単純に個々の患者におけるステージ診断のズレの絶対値をとり、施設毎にその平均を求めた。その結果、ベースラインリスクが高い施設では診断の不一致度が大きく、一方、ベースラインリスクが低い施設では診断の不一致が少ない傾向が観察された。 多施設臨床試験における施設間差の解析の方法論は、依然議論の余地がある。ベースラインリスクに関して観察された施設間差は、各施設の腫瘍外科医の診断の正確さだけでなく、リンパ節郭清が施設によって異なることから生じるstage migrationや各施設の病理診断の違いなどとも関連している可能性もある。このようなすべての要因の複合効果がベースラインリスクを規定しているとすれば、今回の結果は臨床試験に参加している研究者の主観的印象に合致しており、また各施設におけるステージ診断の正確さという客観的評価にも一致した結果となっている。したがって、今回提案した方法論は、多施設臨床試験のデータの解析に有用であると思われる。 5.結論 1.多施設臨床試験における施設間差の影響をモデル化するのに有用なベイズ的階層生存時間モデルを提案した。その事後分布の計算にはGibbs samplingによる方法を提案した。 2.提案した方法論を実際の多施設臨床試験データに応用した結果、治療効果に関する施設間差は小さいことが示され、得られた結論の施設選択に関する一般化可能性は高いと推察された。 |