最近、哺乳類体内(赤血球、水晶体、歯および脳など)に、D-アミノ酸含有ペプチド(蛋白)が見出され、また、生理活性を有するD-アミノ酸含有ペプチドが、両生類の皮膚や神経節より見出されるようになった。しかし、現状では、これらD-アミノ酸含有ペプチド(蛋白)の構造解析には多大の労力と時間が費やされている。即ち、通常のエドマン法で得られるアミノ酸配列には、その絶対配置の情報が欠けているため、その配列結果に基づきL体のみで化学合成したペプチドは天然のペプチドと一致せず、そのため、可能性のあるD-アミノ酸残基含有ペプチドを再度化学合成して、比較同定するという方法が採られるからである。これは、エドマン法の操作中にN端アミノ酸のラセミ化が起こることに起因するが、どの段階でラセミ化が起こるかは知られていなかった(図1)。 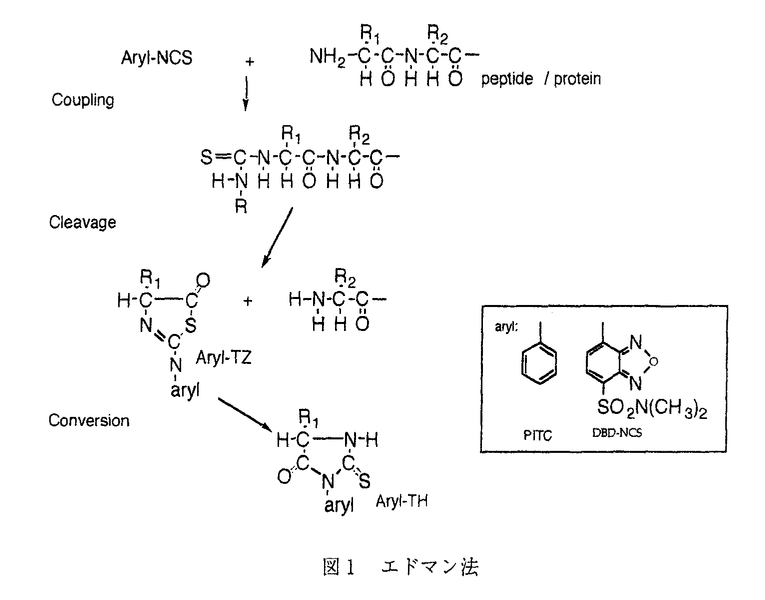 図1 エドマン法1.DBD-チアゾリノン誘導体による高感度N端アミノ酸逐次配列分析法の開発 図1 エドマン法1.DBD-チアゾリノン誘導体による高感度N端アミノ酸逐次配列分析法の開発 松永はまず、エドマン型試薬として、疎水性基であるベンゾフラザン骨格を蛍光団とする4-(N,N-dimethylaminosulfonyl)-7-(2,1,3-benzoxadiazolyl)isothiocyanate(DBD-NCS)を用い検討することにより、従来不安定とされてきた環化/切断反応後に生成するチアゾリノン(TZ)アミノ酸誘導体が、安定な誘導体として検出可能であることを見出し、DBD-TZアミノ酸誘導体をHPLCで分離/同定するN端アミノ酸逐次配列分析法を開発した。 2.エドマン型試薬のパラ位置換基が誘導体のラセミ化に及ぼす影響 この方法は、エドマン反応を1段階省略した、簡便かつ高感度なN端アミノ酸逐次配列分析法であり、これにより、エドマン法の操作中に起こるアミノ酸残基のラセミ化機構を、より詳細に検討することが可能となった。そこで、NCS-基のパラ位に、異なる電子吸引性基を有する置換基を導入したエドマン型蛍光試薬を新規に合成して検討したところ、置換基の電子吸引性とN端TZアミノ酸誘導体のラセミ化率とは、直線的な相関関係を示すことが認められ、電子吸引性の強い置換基を導入した試薬を利用すると、よりラセミ化率が高かった。 3.エドマン法の切断反応時におけるラセミ化機構の解明 ついで、生成するTZアミノ酸誘導体について速度論的に検討し、ラセミ化機構の解明を試みた。環化/切断反応に用いるトリフルオロ酢酸(TFA)中での、DBD-TZアミノ酸誘導体のラセミ化率について調べた結果、一次の可逆反応式に従うことが判った。また、重水素化TFAを用いて環化/切断反応を行い、生成するTZアミノ酸誘導体をLC/MSにより測定した結果、TZアミノ酸誘導体のアミノ酸 位のプロトンが重水素置換され、時間と置換率との関係も一次反応式に従った。これは、環化/切断反応条件下に存在する酸塩基触媒が、TZアミノ酸誘導体のカルボニル及び 位のプロトンが重水素置換され、時間と置換率との関係も一次反応式に従った。これは、環化/切断反応条件下に存在する酸塩基触媒が、TZアミノ酸誘導体のカルボニル及び 位炭素に位置する水素原子に対し各々影響を及ぼす結果、エノール中間体が生成し、それがラセミ化の原因となると推測した。 位炭素に位置する水素原子に対し各々影響を及ぼす結果、エノール中間体が生成し、それがラセミ化の原因となると推測した。 そこで、プロトン置換反応が起きないように非プロトン性触媒である三フッ化ホウ素(BF3)を用い、環化/切断反応を行ったところ、いずれのTZアミノ酸誘導体でもほとんどラセミ化を認めなかった。また、反応が速く反応収率も高いことが判った。これを用いて、D-Phe-Met-Arg-Phe-amide(100 pmol)のアミノ酸逐次配列/絶対配置分析を行ったところ、TFAと比べてBF3による環化/切断反応は、ラセミ化を抑制し、実際試料に適用可能であることが示唆された。このように用手法でも高感度化が達成できたことから、将来自動化により、さらに高感度化が達成できるものと期待されている。 4.TZアミノ酸誘導体のD/L光学分割のためのカラム条件の検討 最後に、TZアミノ酸誘導体のD/L光学分割について、フェニルカルバモイル(PhC)修飾を施した -シクロデキストリン( -シクロデキストリン( -CD)を固定相とする光学活性カラムを用い、PhC修飾率の違いによる光学分割能の変化について種々検討した。その結果、25%PhC修飾化 -CD)を固定相とする光学活性カラムを用い、PhC修飾率の違いによる光学分割能の変化について種々検討した。その結果、25%PhC修飾化 -CDが良い光学認識能を有することが判り、これを用いることにより、全てのTZアミノ酸誘導体のD/L光学分割が可能となった。 -CDが良い光学認識能を有することが判り、これを用いることにより、全てのTZアミノ酸誘導体のD/L光学分割が可能となった。 以上、本研究は、蛍光試薬を用いて、エドマン法の操作段階で起こるラセミ化の機構を明らかにすると同時に、それを基に、ペプチドの1次構造と構成アミノ酸のD/L絶対配置を同時に決定する簡便かつ高感度な方法を初めて提示したものであり、分析化学、生化学の発展に寄与すると思われ、博士(薬学)の学位論文に相応しいと認めた。 |