生体における重要な生理現象、制御機構に関与している酵素の役割を知ることは、生体の制御機構ならびにその調節の破綻である疾病を理解する上で役に立ち、疾病の治療への重要なアプローチの一つであると考えられる。酵素阻害物質とその生物活性に関する研究についても、各酵素による複雑な連鎖的な反応の中で目的の酵素系が、担う役割や疾病の原因となる連鎖系の異常現象の解明あるいは酵素系の調節による治療法の開発に役立つことが期待される。 カルボキシペプチダーゼ(CPase)は、蛋白質、ペプチドのC末端アミノ酸を切断するエキソペプチダーゼであり、古くから膵臓の消化酵素であるCP-AおよびCP-Bなどが知られている。一方Hayashiらは、酵母由来のCP-Yなどが、金属酵素である他のカルボキシペプチダーゼ(Metallo CPase)と異なりセリン酵素であることを明らかにした。これらの酵素は、セリンカルボキシペプチダーゼ(Serine CPase)と呼ばれている。高等動物においては、血小板デアミダーゼやCP-Y様エキソペプチダーゼが報告されているが、その酵素学的性質や生体内での役割についてはほとんど明らかではない。 蛋白質、ペプチドのC末端のアミノ酸配列が、これらの生理活性物質の活性発現に直接重要な役割を持っている例として、ブラジキニンのC末端Arg、サブスタンスPやニューロキニンAのC末端のアミドなどが知られている。これらのペプチドのC末端アミノ酸配列を調節する酵素としては、血中においてブラジキニンのC末端Argを切断し、活性発現調節を行っているCP-Nが知られている。Serine CPaseとしては、ブラジキニンのC末端Argを切断する活性を有するヒト血小板由来のデアミダーゼが精製されている。デアミダーゼは、またサブスタンスP、ニューロキニンAのC末端アミドを切断することが知られている唯一の酵素であり、C末端アミドを有するペプチドの生体内での活性発現調節におけるこの酵素の重要性が予想される。 ブラジキニン分解酵素としては、ACEおよびCP-Nが、血中ブラジキニン分解の中心的な役割を持つことが知られているが、一方Majimaらは、腎臓組織におけるブラジキニンの主要な分解酵素は、中性エンドペプチダーゼ(NEP)およびSerine CPaseの一種であるCP-Y様エキソペプチダーゼであることを見いだしている。さらに、Katoriらは腎臓で生成するブラジキニンの低下が高血圧症の発症に大きな役割を持つことを示す結果を報告している。CP-Y様エキソペプチダーゼは、デアミダーゼと共通の抗原性を持つSerine CPaseであると考えられているが、酵素蛋白の分子構造、発現部位、発現調節については知られておらず、この酵素についてもより詳細な研究が求められている。 筆者は、CP-Y阻害物質のスクリーニング系を確立し、Serine CPaseに対する阻害物質を微生物培養液中に探索した。その結果、ベラクチン類(Figure 1)ならびにピペラスタチン類(Figure 2)を発見し、その構造および性質さらにSerine CPaseの生体内での役割などについて検討した。 以下に、本研究により明らかにされた事項について述べる。 (1)Serine CPase阻害物質を微生物培養液中に探索し、Saccharopolyspora sp.MK19-42F6が、Serine CPase阻害物質を生産していることを見いだし、ベラクチンと命名した。 (2)Saccharopolyspora sp.MK19-42F6株を培養し、溶媒抽出、シリカゲルカラム、Sephadex LH-20カラム、逆相HPLCおよび遠心液液分配クロマトグラフィーにより、黄薄色粉末としてベラクチンAが、白色粉末としてベラクチンBが精製された。 (3)ベラクチンAおよびBの構造は、物理化学的性質、NMRを中心とした各種スペクトル解析により、それぞれ4-[3-[(2-amino-5-chlorobenzoyl)amino]-1,1-dimethyl-2-oxobutyl]-3-methyl-2-oxetanoneおよび4-[3-[[2-(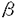 -glucopyranosylamino)-5-chlorobenzoyl]amino]-1,1-dimethyl-2-oxobutyl]-3-methyl-2-oxetanoneと決定した。 -glucopyranosylamino)-5-chlorobenzoyl]amino]-1,1-dimethyl-2-oxobutyl]-3-methyl-2-oxetanoneと決定した。 (4)X線結晶解析によりベラクチンAの絶対構造は[3S-[3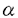 ,4 ,4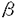 (3S*)]]-4-[3-[(2-amino-5-chlorobenzoyl)amino]-1,1-dimethyl-2-oxobutyl]-3-methyl-2-oxetanoneと決定した。ベラクチンAの開環誘導体では、CP-Y阻害活性を失うことから、ベラクチンの (3S*)]]-4-[3-[(2-amino-5-chlorobenzoyl)amino]-1,1-dimethyl-2-oxobutyl]-3-methyl-2-oxetanoneと決定した。ベラクチンAの開環誘導体では、CP-Y阻害活性を失うことから、ベラクチンの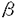 -ラクトン構造が、酵素阻害発現に必須であった。 -ラクトン構造が、酵素阻害発現に必須であった。 (5)ベラクチンAおよびBのCP-Yに対するIC50値は、0.18および0.65 g/mlであった。ベラクチン類は、各種のプロテアーゼの中でDPP-IおよびPEPをわずかながら阻害するもののCP-Yに特異性が高い阻害物質であることが明らかになった。 g/mlであった。ベラクチン類は、各種のプロテアーゼの中でDPP-IおよびPEPをわずかながら阻害するもののCP-Yに特異性が高い阻害物質であることが明らかになった。 (6)ベラクチン類は、酵素との前培養時間に依存してCP-Y阻害作用を発現した。ベラクチンAおよびBのCP-Yに対する阻害形式は、Bz-Gly-Pheの基質に対して混合非拮抗型を示し、そのKi値は、それぞれ0.14 Mおよび0.27 Mおよび0.27 Mであった。 Mであった。 (7)基質としてBz-Tyr-pNAを用いた酵素反応の前定常状態解析によりベラクチンAのCP-Yに対する阻害がslow-binding typeであることが示された。ベラクチンAとCP-Yの結合状態が、酵素-阻害剤複合体形成反応の蛍光測定および差スペクトル測定により観測され、ベラクチンAによるCP-Y阻害が、slow-binding typeであることが確認された。 (8)Serine CPase阻害物質を微生物培養液中に探索し、Streptomyces lavendofoliae MJ908-WF13株が、Serine CPase阻害物質を生産していることを見いだし、ピペラスタチンと命名した。 (9)Streptomyces lavendofoliae MJ908-WF13株の培養液から活性炭カラム、シリカゲルカラム、逆相ODSカラム、遠心液液分配クロマトグラフィー、Sephadex LH20カラムおよび逆相HPLCにより無色針状結晶としてピペラスタチンAおよび白色粉末としてピペラスタチンBが精製された。 (10)ピペラスタチンAおよびBの構造は、ピペラスタチン類ならびにピペラスタチン類誘導体の物理化学的性質、アミノ酸分析、NMRを中心とした各種スペクトル解析により、それぞれN-formyl-allo Ile-Thr-Leu-Val-Pip-Leu-Pip(Pip=hexahydropyridadine-3-carboxylic acid)および N-formyl-Val-Thr-Leu-Val-Pip-Leu-Pipと決定した。 (11)ピペラスタチンAおよびBのCP-Yに対するIC50値は、52および60ng/mlであった。ピペラスタチン類は、各種のプロテアーゼの中でACEをわずかながら阻害するもののCP-Yに特異性が高い阻害物質であった。CP-Yに対するピペラスタチンAおよびBの阻害形式は拮抗型を示し、そのKi値は、それぞれ52nMおよび55nMであった。 (12)ピペラスタチン類は、ラット血中でのブラジキニン分解には影響を示さずにCP-Y様エキソペプチダーゼを阻害し、ラット尿中のブラジキニン分解を特異的に抑制した。ピペラスタチンAをラットに投与することにより尿中のCPaseが阻害され、尿中ブラジキニン濃度が一過的に高まることで利尿効果が生ずることが確認された。  図表Figure 1 Structures of belactins A and B Figure 2 Structures of piperastatins A and B 図表Figure 1 Structures of belactins A and B Figure 2 Structures of piperastatins A and B ベラクチンおよびピペラスタチンは、Serine CPaseに特異性の高い阻害物質として初めて報告された新規天然化合物である。ベラクチンは、酵素阻害活性の発現に重要な役割を持つ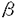 -ラクトン構造を有し、またslow binding-type阻害物質という特徴を持つ。一方ピペラスタチンは、生体内でのSerine CPaseを特異的に阻害し、この阻害により尿中のブラジキニンの分解を抑制して利尿作用を誘起する化合物である。これらの阻害化合物は、生体内での役割が未だ明らかでないSerine CPaseの研究進展のために大いに役立つと考えられ、さらに本態性高血圧症などの原因解明あるいは治療へのアプローチなどにも寄与することが期待される。 -ラクトン構造を有し、またslow binding-type阻害物質という特徴を持つ。一方ピペラスタチンは、生体内でのSerine CPaseを特異的に阻害し、この阻害により尿中のブラジキニンの分解を抑制して利尿作用を誘起する化合物である。これらの阻害化合物は、生体内での役割が未だ明らかでないSerine CPaseの研究進展のために大いに役立つと考えられ、さらに本態性高血圧症などの原因解明あるいは治療へのアプローチなどにも寄与することが期待される。 |