【背景および目的】 細胞周期は、G1期→S期→G2期→M期と進行する。その進行には、サイクリンとサイクリン依存性キナーゼ(cdk)複合体によるリン酸化反応が必須であり、各々の細胞周期において特定のサイクリンが上昇することが知られている。細胞周期の制御因子の研究は、主にガン細胞を用いて進められてきており、心血管系細胞における細胞周期制御因子・サイクリンの発現調節についての報告は少ない。
ヒトを含む哺乳類の心筋細胞は胎児期にさかんに分裂するが、出生後間もなく分裂を停止しその後は二度と細胞周期に入らないと考えられている。そのため、虚血性心疾患などで傷害を受けた心筋組織は再生できない。その心筋細胞の分裂停止のメカニズムを知るためには、サイクリンの発現を検討する必要がある。
また血管内皮細胞は、培養系でコンフルエントになると接触阻止を生じ分裂を停止する。この現象は生体内でも同様に起こり、単層を維持し血管壁の物質の透過性の調節に重要な役割を果たしていると考えられる。この接触阻止による内皮細胞分裂停止のメカニズムの解明にも、サイクリンの発現とその調節機構の検討が重要である。
本研究の目的は、これらの心血管系細胞におけるサイクリンの発現を検討し、さらにそのサイクリンの発現を転写レベルで調節している機構を解明することにある。
【結果】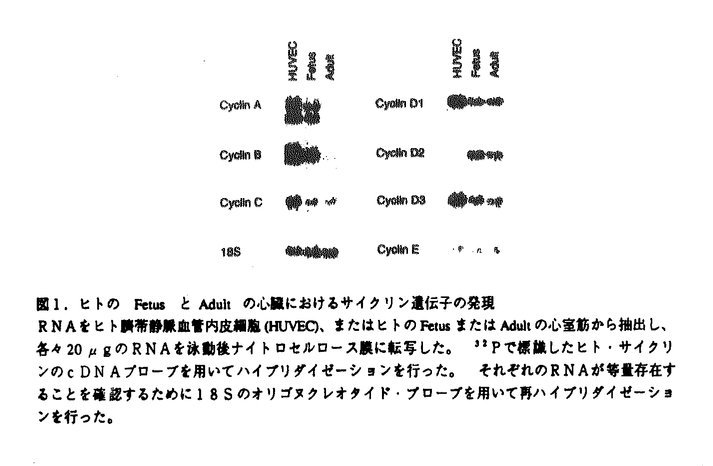 図1.ヒトのFetusとAdultの心臓におけるサイクリン遺伝子の発現RNAをヒト臍帯静脈血管内皮細胞(HUVEC)、またはヒトのFetusまたはAdultの心室筋から抽出し、各々20
図1.ヒトのFetusとAdultの心臓におけるサイクリン遺伝子の発現RNAをヒト臍帯静脈血管内皮細胞(HUVEC)、またはヒトのFetusまたはAdultの心室筋から抽出し、各々20 gのRNAを泳動後ナイトロセルロース膜に転写した。32Pで標識したヒト・サイクリンのcDNAプローブを用いてハイブリダイゼーションを行った。それぞれのRNAが等量存在することを確認するために18Sのオリゴヌクレオタイド・プローブを用いて再ハイブリダイゼーションを行った。
gのRNAを泳動後ナイトロセルロース膜に転写した。32Pで標識したヒト・サイクリンのcDNAプローブを用いてハイブリダイゼーションを行った。それぞれのRNAが等量存在することを確認するために18Sのオリゴヌクレオタイド・プローブを用いて再ハイブリダイゼーションを行った。 まず第一に、ヒトのFetusとAdultの心室筋からRNAを抽出し、サイクリンA,B,C,D1,D2,D3,およびEの発現をノーザン・ブロット法により検討した。その結果、G1サイクリンに属するサイクリンC,D1,D2,D3,Eのヒト心室組織における発現は、FetusとAdultで差を認めなかった。一方、M期に重要なサイクリンBは、Fetusで強く発現しているが、Adultでの発現は著明に低下した。興味深いことにS期からM期にかけて重要なサイクリンAは、Fetusで強く発現しているが、Adultでは発現が全く認められなかった。ヒトFetusの心室組織においてサイクリンAを発現している細胞が心筋細胞であることを確認するため免疫組織染色を行ったところ、サイクリンA陽性の細胞は心筋細胞であり、心筋細胞の4%がサイクリンAを発現していることが判明した。そのサイクリンA陽性の心筋細胞は、分裂細胞のマーカーであるPCNAを発現していた。
次に、心筋におけるサイクリンAの発現が、発達段階でどのように調節されているかを検討するために、異なる週令のラットの心室筋中のラット・サイクリンAの発現を検討した。その結果サイクリンAは、Fetusで強く発現しているが、生後2日ではその発現は37%に低下し、14日には発現が全く認められなかった。このサイクリンAの変動は、蛋白レベルでもウエスタンブロットで確認された。また、生後2日のラットの心臓におけるサイクリンA陽性の細胞は、ヒトFetusと同様に心筋細胞であることが確認された。このように、心筋細胞の分裂の停止に伴い、サイクリンAとBが低下し、特にサイクリンAの発現が完全に消失することが判明した。
第二に、サイクリンAの血管壁細胞での発現調節を検討した。接触阻止によって分裂を停止したウシ大動脈内皮細胞(BAEC)では、サイクリンAの発現が低下していたが、サイクリンD1の低下は認められなかった。サイクリンA遺伝子発現を調節するメカニズムを解明するため、サイクリンAのプロモーターを単離したのち様々な長さにしルシフェラーゼ遺伝子に結合したものをBAECにトランスフェクションし、増殖中のBAECにおいてその活性を検討した。サイクリンAのプロモーター活性は、約3400塩基のサイクリンA遺伝子5’上流配列を含むリポーター・プラスミド(-3200/+245)から約300塩基のもの(-133/+205)まで基本的には不変であった。その300塩基のうち、ATFコンセンサス配列(TGACGTCA)を含む上流側を短縮したプラスミド(-23/+205)の活性は非常に低下した。しかし下流側を短縮したもの(-133/+100および-133/-2)の活性は低下したもののかなり残存した。
さらに、各々のリポーター・プラスミドを用いて、接触阻止時と増殖時のその活性を比較した。約3400塩基のもの(-3200/+245)から約300塩基のもの(-133/+205)までは、増殖時の活性を100%とすると接触阻止時にはその5〜8%に活性が抑制された。興味深いことに、プラスミド(-133/+100)およびプラスミド(-133/-2)ともに接触阻止によるプロモーター活性の抑制は保たれていた。すなわち、約130塩基(-133/-2)部分だけが、サイクリンAのプロモーター活性が接触阻止によって抑制されるためには十分であることが分かった。
また、この約130塩基(-133/-2)部分のうちで、ATFコンセンサス配列(TGACGTCA)がサイクリンAのプロモーター活性の制御に重要である可能性を検討するために、ATFコンセンサス配列に変異を作ったリポーター・プラスミドを2種類作成した。約500塩基のもの(-266/+205)と約300塩基のもの(-133/+205)の両者のATFコンセンサス配列部分(TGACGTCA)を(TGCCCCCA)と変異させた。増殖中のBAECにおいて、変異させたリポーター・プラスミドの活性は著明に低下した。また変異プラスミドの活性は接触阻止によって変化を受けなかった。
次に、サイクリンAのプロモーター活性がATFコンセンサス配列を介してどのように制御されているかを検討するために、約130塩基(-133/-2)部分をプローブとしてゲル・シフト・アッセイを行った。増殖中のBAECから得られた核抽出物中に、このプローブのATFコンセンサス配列部分と特異的に結合する蛋白複合体があること、その複合体は接触阻止下にあるBAECから得られた核抽出物中で減少していることが判明した。
ATFコンセンサス配列と特異的に結合する蛋白複合体を詳しく検討するため、ATFコンセンサス配列(TGACGTCA)を含む22塩基のオリゴヌクレオタイド・プローブを作成し、ゲル・シフト・アッセイを行った。増殖中のBAECから得られた核抽出物中には、このプローブと特異的に結合する蛋白複合体があり、その複合体は接触阻止下にあるBAECから得られた核抽出物中では減少していた。さらに、ATFコンセンサス配列と結合することが知られている転写調節因子に対する抗体を用いて、スーパーシフト・アッセイを行った。ATF-1もしくはCREBに対する抗体で、ゲル・シフトのバンドが減弱もしくは、上方に移動した。この結果は、少なくともこの2者が複合体の構成要素であることを示している。最後に、ATFコンセンサス配列に結合する可能性のある転写調節因子の発現をmRNAレベルで検討した結果、ATF-1のmRNAレベルは、増殖中のBAECに較べて接触阻止下にあるBAECで低下していた。一方ATF-2、Jun、およびCREBは変化しなかった。