近年の細胞生物学の進歩により、イノシトールリン脂質の代謝が様々な細胞機能に重要であることが、明らかとなってきた。なかでも重要な発見の一つは、I型フォスファチジルイノシトール4リン酸5キナーゼ(PIP5K)及びフォスファチジルイノシトール輸送蛋白が、ATP依存的なカルシウムによる分泌機構の必須要素として、同定されたことである。PIP5Kは、フォスファチジルイノシトール4リン酸(PI4P)から、フォスファチジルイノシトール4,5ビスリン酸(PIP2)を生成する脂質リン酸化酵素であり、フォスファチジン酸(PA)により活性が増強するI型と増強しないII型が存在する。膵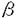 細胞からのインスリンの分泌も、ATP依存性のカルシウムにより惹起される過程であり、I型PIP5Kが重要な役割を果たす可能性が想像される。そこで、本研究では膵 細胞からのインスリンの分泌も、ATP依存性のカルシウムにより惹起される過程であり、I型PIP5Kが重要な役割を果たす可能性が想像される。そこで、本研究では膵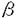 細胞株であるMIN6細胞を用い、PIP5Kに相同の分子の存在をPCR法を応用して探索した。その結果、三種類の新規のPIP5KのcDNAが単離された。いずれもPAによる活性増強を認め、I型アイソフォームであった。得られた新規のPIP5Kは、フォスファチジルイノシトール3キナーゼ(PI3K)やフォスファチジルイノシトール4キナーゼ(PI4P)と相同性を有さない全く新しい脂質キナーゼであり、構造と機能の関係に興味がもたれた。そこで本論文では、合計19個の欠失または点変異体を作成し、構造上の特徴についても解析を行った。 細胞株であるMIN6細胞を用い、PIP5Kに相同の分子の存在をPCR法を応用して探索した。その結果、三種類の新規のPIP5KのcDNAが単離された。いずれもPAによる活性増強を認め、I型アイソフォームであった。得られた新規のPIP5Kは、フォスファチジルイノシトール3キナーゼ(PI3K)やフォスファチジルイノシトール4キナーゼ(PI4P)と相同性を有さない全く新しい脂質キナーゼであり、構造と機能の関係に興味がもたれた。そこで本論文では、合計19個の欠失または点変異体を作成し、構造上の特徴についても解析を行った。 [方法] 既知のII型PIP5Kおよびその出芽酵母の相同体であるMss4pとFablpのアミノ酸配列中,高度に保存されてる二箇所に対して、変性オリゴヌクレオチドプライマーを作成し、マウス膵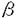 細胞株であるMIN6細胞のメッセンジャーRNAを鋳型としてPCRを行なった。得られたDNAの塩基配列を決定し、次にそれらをプローブとして、MIN6細胞のcDNAライブラリーをスクリーニングし、三種の完全長cDNAを得た。これらのcDNAはアデノウイルスベクターを用いて発現させ、活性の測定等に用いた。活性の測定は、放射性ラベルしたATPを基質としてリン酸化反応を行い、反応産物を薄層クロマトグラフィーにより分離し、画像解析装置にて定量化した。 細胞株であるMIN6細胞のメッセンジャーRNAを鋳型としてPCRを行なった。得られたDNAの塩基配列を決定し、次にそれらをプローブとして、MIN6細胞のcDNAライブラリーをスクリーニングし、三種の完全長cDNAを得た。これらのcDNAはアデノウイルスベクターを用いて発現させ、活性の測定等に用いた。活性の測定は、放射性ラベルしたATPを基質としてリン酸化反応を行い、反応産物を薄層クロマトグラフィーにより分離し、画像解析装置にて定量化した。 「結果」 マウス膵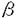 細胞株のMIN6細胞cDNAライブラリーより、II型PIP5Kと相同性を有する三種類の新規分子が得られ、PIP5K-I 細胞株のMIN6細胞cDNAライブラリーより、II型PIP5Kと相同性を有する三種類の新規分子が得られ、PIP5K-I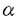 ,PIP5K-I ,PIP5K-I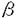 ,及びPIP5K-I ,及びPIP5K-I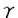 と名付けた。PIP5K-I と名付けた。PIP5K-I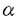 ,PIP5K-I ,PIP5K-I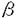 は、各々539,546個のアミノ酸よりなる蛋白であり、ソディウムドデシル硫酸-ポリアクリルアミドゲル電気泳動(SDS-PAGE)上、68kDaに泳動された。また、PIP5K-I は、各々539,546個のアミノ酸よりなる蛋白であり、ソディウムドデシル硫酸-ポリアクリルアミドゲル電気泳動(SDS-PAGE)上、68kDaに泳動された。また、PIP5K-I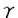 はカルボキシル端(C-端)に26個のアミノ酸が付加するものとないものの二種が存在し、合計635あるいは661個のアミノ酸よりなる蛋白で、87または90kDaに泳動された。これら蛋白のアミノ酸配列を比較すると、中央部分が約80%の一致性を有し、さらにPIP5K-I はカルボキシル端(C-端)に26個のアミノ酸が付加するものとないものの二種が存在し、合計635あるいは661個のアミノ酸よりなる蛋白で、87または90kDaに泳動された。これら蛋白のアミノ酸配列を比較すると、中央部分が約80%の一致性を有し、さらにPIP5K-I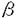 とPIP5K-I とPIP5K-I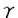 のアミノ端(N-端)にもアミノ酸配列上約40%の一致性を認めた。一方、C-端は三種のアイソフォームで大きく異なった。次に、三種の新規蛋白が実際に酵素活性を有しているか否かを検討するため、各々のcDNAにインフルエンザウイルス赤血球凝集素(HA)の一部をコードする配列を付加してCOS7細胞に導入し、発現した蛋白をHAに対する抗体で免疫沈降して、活性測定を行った。三種類ともPI4PとATPを基質として、PIP2の生成を認めた。またこの反応はPAの添加により10倍前後に増強されたことから、新規分子はいずれもI型アイソフォームであった。さらに、マウス組織での発現分布をノーザンブロット法により検討すると、三種類のアイソフォームの発現組織は各々異なっており、特にI のアミノ端(N-端)にもアミノ酸配列上約40%の一致性を認めた。一方、C-端は三種のアイソフォームで大きく異なった。次に、三種の新規蛋白が実際に酵素活性を有しているか否かを検討するため、各々のcDNAにインフルエンザウイルス赤血球凝集素(HA)の一部をコードする配列を付加してCOS7細胞に導入し、発現した蛋白をHAに対する抗体で免疫沈降して、活性測定を行った。三種類ともPI4PとATPを基質として、PIP2の生成を認めた。またこの反応はPAの添加により10倍前後に増強されたことから、新規分子はいずれもI型アイソフォームであった。さらに、マウス組織での発現分布をノーザンブロット法により検討すると、三種類のアイソフォームの発現組織は各々異なっており、特にI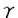 アイソフォームは、脳において強く発現することが明らかとなった。 アイソフォームは、脳において強く発現することが明らかとなった。 次に、三種類のI型アイソフォームの酵素活性の特徴を、既知のII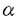 アイソフォームとともに検討した。三種のI型アイソフォームのいずれもII アイソフォームとともに検討した。三種のI型アイソフォームのいずれもII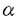 アイソフォームと比べ、ATPに対する親和性は低くPI4Pに対する親和性は高かった。また、II アイソフォームと比べ、ATPに対する親和性は低くPI4Pに対する親和性は高かった。また、II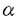 アイソフォームは、I型アイソフォームのいずれよりも50培以上活性が低かった。そして、I型アイソフォームの中では、I アイソフォームは、I型アイソフォームのいずれよりも50培以上活性が低かった。そして、I型アイソフォームの中では、I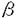 アイソフォームが最も活性が高かった。またPAによる活性増強は、I アイソフォームが最も活性が高かった。またPAによる活性増強は、I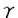 アイソフォームで最も強く、II アイソフォームで最も強く、II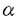 アイソフォームではわずかであった。 アイソフォームではわずかであった。 PIP5Kのアイソフォームにはいずれも、既知のPI3KやPI4Kの活性領域とアミノ酸配列上相同な部分が存在せず、構造と機能の関係に興味がもたれた。そこでまずI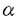 アイソフォームについて、N-端およびC-端の様々な長さの欠失体を作成し酵素活性を検討した。C-端は全長539個のアミノ酸のうち400番目まで欠失させても、大きな活性の変化を認めなかったが、393番目まで欠失させるとほぼ完全に活性が失われた。これに対しN-端は、17個の欠失では活性に変化を認めなかったが、31個の欠失で約1/3の活性に低下し、46個の欠失ではほぼ完全に活性が失われた。この検討により、アミノ酸18番から399番の約380個の領域が活性領域を形成すると考えられた。 アイソフォームについて、N-端およびC-端の様々な長さの欠失体を作成し酵素活性を検討した。C-端は全長539個のアミノ酸のうち400番目まで欠失させても、大きな活性の変化を認めなかったが、393番目まで欠失させるとほぼ完全に活性が失われた。これに対しN-端は、17個の欠失では活性に変化を認めなかったが、31個の欠失で約1/3の活性に低下し、46個の欠失ではほぼ完全に活性が失われた。この検討により、アミノ酸18番から399番の約380個の領域が活性領域を形成すると考えられた。 いくつかの蛋白キナーゼや脂質キナーゼでは、グリシンに富む領域とその10から30残基下流のリジン残基が、リン酸基の転移反応に重要であることが知られている。PIP5Kのいずれのアイソフォームにも、この配列に典型的ではないが弱い相同性を有する領域が存在し、I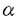 アイソフォームではアミノ酸121番から138番がこれにあたる。そこで、この領域が重要か否かを検討するため、124番目のグリシンをバリン(G124V)に、また138番目のリジンをアラニン(K138A)に変異させたI アイソフォームではアミノ酸121番から138番がこれにあたる。そこで、この領域が重要か否かを検討するため、124番目のグリシンをバリン(G124V)に、また138番目のリジンをアラニン(K138A)に変異させたI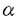 アイソフォームを作成し解析すると、G124V変異体ではリン酸化活性は野生体の約2/3の活性に低下し、K138A変異体ではほとんど活性を認めなかった。従って、I アイソフォームを作成し解析すると、G124V変異体ではリン酸化活性は野生体の約2/3の活性に低下し、K138A変異体ではほとんど活性を認めなかった。従って、I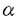 アイソフォームのアミノ酸121番から138番の領域は、リン酸基の転移反応に重要な役割を果たしているものと推察された。 アイソフォームのアミノ酸121番から138番の領域は、リン酸基の転移反応に重要な役割を果たしているものと推察された。 三種類のI型アイソフォームは、80%の一致性を示す中央部分と相同性の少ないN-端およびC-端からなることから、両端の領域が各々のアイソフォームの特徴に関与している可能性が考えられる。そこで、I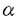 アイソフォームの結果をもとに、三種類のI型アイソフォームよりN-端あるいはC-端のみ、または両端とも欠失させた蛋白を作成し、酵素活性とPAに対する感受性を検討した。その結果、三種類のアイソフォームのうち、I アイソフォームの結果をもとに、三種類のI型アイソフォームよりN-端あるいはC-端のみ、または両端とも欠失させた蛋白を作成し、酵素活性とPAに対する感受性を検討した。その結果、三種類のアイソフォームのうち、I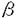 アイソフォームの活性は最も高いが、C-端を欠失させるとI アイソフォームの活性は最も高いが、C-端を欠失させるとI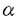 アイソフォームと同程度の活性に低下することが明らかとなった。また、各々のアイソフォームとも活性領域のみでPAに対する感受性を有することが示された。そして、I アイソフォームと同程度の活性に低下することが明らかとなった。また、各々のアイソフォームとも活性領域のみでPAに対する感受性を有することが示された。そして、I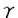 アイソフォームのPAに対する感受性は三種のうちで最も高いが、そのC-端を欠失させるとI アイソフォームのPAに対する感受性は三種のうちで最も高いが、そのC-端を欠失させるとI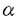 アイソフォームと同程度の感受性にまで低下することが明らかとなった。 アイソフォームと同程度の感受性にまで低下することが明らかとなった。 [考察] マウス膵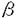 細胞株MIN6細胞より、三種類のI型PIP5Kをクローニングすることに成功した。これらは、SDS-PAGE上の泳動度から、従来蛋白レベルで精製されていたIa(68kDa)およびIb(90kDa)アイソフォームに対応するものと考えられる。事実、これらのI型アイソフォームの活性の特徴は、IaおよびIbアイソフォームの性質と合致するものである。また今回の検討で、II 細胞株MIN6細胞より、三種類のI型PIP5Kをクローニングすることに成功した。これらは、SDS-PAGE上の泳動度から、従来蛋白レベルで精製されていたIa(68kDa)およびIb(90kDa)アイソフォームに対応するものと考えられる。事実、これらのI型アイソフォームの活性の特徴は、IaおよびIbアイソフォームの性質と合致するものである。また今回の検討で、II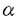 アイソフォームの活性がI型アイソフォームに比べ、非常に低いことが明らかとなった。 アイソフォームの活性がI型アイソフォームに比べ、非常に低いことが明らかとなった。 三種類のI型アイソフォームが、インスリン分泌細胞に同時に発現することから、これらのアイソフォームは細胞内で各々異なる役割を担っている可能性が示唆される。これは、三種類のI型アイソフォームが異なる組織分布を示すことからも想像される。細胞質を除いたクロム親和性細胞での再構成実験では、90kDaのアイソフォームの方が、68kDaのものより強くカテコールアミンの分泌を再現することが、報告されており、制御的分泌にはI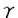 アイソフォームが、重要な働きを担っている可能性が考えられる。I アイソフォームが、重要な働きを担っている可能性が考えられる。I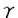 アイソフォームが特に脳において強く発現していることは、このアイソフォームの神経伝達物質放出における役割を反映しているのかもしれない。 アイソフォームが特に脳において強く発現していることは、このアイソフォームの神経伝達物質放出における役割を反映しているのかもしれない。 cDNAのクローニングにより、構造と機能の関係の解析が可能となり、まずI型アイソフォームの約380個のアミノ酸からなる領域が活性領域であり、その中のアミノ酸121番から138番の領域が、蛋白キナーゼと基本的には同様な機構で、リン酸化反応に関与することが示唆された。またI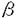 アイソフォームとI アイソフォームとI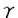 アイソフォームのC-端の領域が、脂質リン酸化反応の修飾に重要な役割を担う可能性が示唆された。さらに、PAに対する感受性は、I型アイソフォームの活性領域のみでも存在することが明らかになった。マウスのII アイソフォームのC-端の領域が、脂質リン酸化反応の修飾に重要な役割を担う可能性が示唆された。さらに、PAに対する感受性は、I型アイソフォームの活性領域のみでも存在することが明らかになった。マウスのII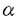 アイソフォームは405個のアミノ酸からなり、I型アイソフォームの活性領域に対応し、約40%の一致性を有する。このことから、II型アイソフォームでPAに対する感受性がわずかであるのは、II型でN-端及びC-端の付加配列が存在しないためではなく、II型の活性領域固有の性質によるものと考えられた。 アイソフォームは405個のアミノ酸からなり、I型アイソフォームの活性領域に対応し、約40%の一致性を有する。このことから、II型アイソフォームでPAに対する感受性がわずかであるのは、II型でN-端及びC-端の付加配列が存在しないためではなく、II型の活性領域固有の性質によるものと考えられた。 本研究で、I型アイソフォームのcDNAが単離されたことにより、イノシトールリン脂質代謝が関与する様々な細胞機能の理解が、さらに進展するものと期待される。そのためには、PIP5Kの構造と機能の関係や、活性調節の機構などさらに明らかにされなければならないことが多く存在する。本研究で作成したいくつかの変異体は、PIP5Kの細胞内での機能の今後の研究にとっても役にたつものと思われる。 |