学位論文要旨
| No | 213655 | |
| 著者(漢字) | 加藤,将夫 | |
| 著者(英字) | Kato,Yukio | |
| 著者(カナ) | カトウ,ユキオ | |
| 標題(和) | 肝細胞増殖因子の非線形体内動態とヘパリンならびにプロタミンによる動態制御 | |
| 標題(洋) | Nonlinear pharmacokinetics of hepatocyte growth factor and its control using heparin and protamine | |
| 報告番号 | 213655 | |
| 報告番号 | 乙13655 | |
| 学位授与日 | 1998.01.14 | |
| 学位種別 | 論文博士 | |
| 学位種類 | 博士(薬学) | |
| 学位記番号 | 第13655号 | |
| 研究科 | ||
| 専攻 | ||
| 論文審査委員 | ||
| 内容要旨 | 肝細胞増殖因子(HGF)は、成熟肝細胞に対する最も強力な増殖因子であることから、肝疾患治療薬としての開発が期待されている。しかしながらin vivoで十分な治療効果を得るには極めて高投与量を必要とする。その原因の一つとして血中半減期が極めて短いことが挙げられる。従って、HGFの臨床応用には体内動態機構に基づいた適切な方法論により低投与量で有効な治療効果を発揮させることが重要である。これまで125I標識体を用いた解析から、tracer条件下でのHGFの主な消失臓器は肝臓であり、そのメカニズムは受容体介在性エンドサイトーシス(RME)とそれ以外の取り込み機構であることが明らかにされている。後者のメカニズムは不明であるが、細胞表面のヘパラン硫酸プロテオグリカン(HSPG)を介する機構であることが考えられている。しかしこれら体内動態に関する報告はすべてtracer条件下に限られていることから、本研究においては、(i)薬理効果の得られる投与量も含めた種々の投与量におけるHGFの非線形体内動態ならびに消失機構を明らかにするとともに、(ii)HGFをin vivoでより有効に効かせるための方法論を構築することを目的として以下の検討を行った。 Tracer量の125I-HGFとヘパリンとをあらかじめ混合させた後にラットに静注し、血漿中トリクロロ酢酸沈殿性放射活性を測定したところ、30分までの血漿中濃度下面積(AUC)はヘパリンによって約2-3倍に増加し、またその効果は2種類の分子量のヘパリンにおいて同様に観察された。放射活性の臓器分布を測定したところ、HGFの主な分布臓器である肝臓、副腎、肺、脾臓、腎臓などいずれの臓器への分布もヘパリンによりほぼ半分程度に低下した。臓器分布をkg体重当たりに換算すると、主に肝臓への分布を低下させることによって、血中滞留性の上昇したことが示唆された。実際、ラット肝灌流系における125I-HGFの肝抽出率もヘパリンによって低下したことから、肝臓での消失がヘパリンによって抑えられることが示された。 HGFによるラット初代培養肝細胞に対するDNA合成促進効果をヘパリン存在下で検討したところ、ヘパリン存在下ではHGF効果のEC50が約2-3倍程度上昇していた一方、HGFの最大効果にはほとんど影響がなかった(Fig.1A)。この実験条件下において、35S-heparinとHGFとの結合パラメータから計算されたHGF分子上のヘパリン結合部位のヘパリンによる占有率はいずれもほぼ100%に近く、大部分のHGFがヘパリンと結合していることが示唆された(Fig.1B)。以上よりヘパリンはHGFの最大効果にはほとんど影響しないもののレセプターに対する見かけの親和性を低下させることが示唆された。  ラットに種々の投与量のHGFを静注後、血漿中HGF濃度の時間推移をEIAにて測定した。投与量の上昇とともにHGF消失の遅延が見られた。全身クリアランス(CLplasma)は投与量の上昇とともに減少し体内動態の非線形性が示された。CLplasmaの減少は二相観察され(Fig.2)、従って少なくとも2種類の非線形消失機構の存在が示唆された。また、種々の投与量のHGFの消失が肝結紮ラットにおいて大きく遅延していたことから、体内動態に非線形性の観察される投与量においても肝臓が主要な消失臓器であることが示された。以前の研究結果から、肝における消失機構のうちRMEの方がそれ以外の消失機構よりも高親和性であることが知られている。従って、肝臓におけるこれら2つの消失機構の飽和によってHGFの体内動態に非線形性の生じることが示唆された。  高投与量(1.46nmol/kg)HGFの体内動態に及ぼすヘパリンの効果を検討した。ヘパリンは投与量依存的にHGFの消失を遅延させ、その効果はヘパリンの臨床投与量に近い0.4mg/kgで最大であった。この時の血漿中HGF濃度のAUCはコントロールに比べ約20倍近くも上昇し、ヘパリンがHGFの血中滞留性を大きく上昇させることが明らかとなった。また、ヘパリンによるHGFのCLplasma低下効果はHGFが高投与量である方が低投与量よりも顕著であった(Table 1)。またCLplasmaの飽和性部分はヘパリン存在下でも非存在下の約半分が観察された(Table 1)。低投与量HGFでは投与されたHGFはレセプターとヘパラン硫酸の両方に結合する。ヘパリンによって後者の結合は特に大きく低下するが、前者は比較的阻害されない。一方でHGF高投与量ではレセプター結合が飽和するため大部分後者の方に結合する。従ってヘパリンによってCLplasmaの大部分が減少すると考えられる。CLplasmaの飽和性部分の約半分がヘパリンで低下したことは、HGFとレセプターとの見かけの親和性が2-3倍低下したこと(Fig.1)ともほぼ合致しており、ヘパリンによってレセプターへの親和性が少なくとも半分程度阻害されることが示唆された。  プロタミンと親和性を有する35S-heparinを分子量分画しHGFとの結合を限外濾過法にて測定したところ、両者の親和性は解離定数0.3-0.5nMと高親和性である一方、ヘパリン一分子にHGF8-12分子が結合しうることが示唆された。これはHGF一分子と結合できる最小単位が5-6炭糖に相当することを意味する。 ヘパリンがHGFの生物活性を阻害することから、新たにプロタミンを用いたDDSを考案した。プロタミンを前投与することでヘパラン硫酸へのHGFの結合をブロックし血中滞留性の上昇を期待した。In vivoにおけるHGFの効果をANIT肝障害ラットを用い検討したところ、プロタミン前投与により肝細胞labeling indexはHGF単独の4-5倍に増加した(Fig.3)。この作用はプロタミン投与量依存的であり、30%肝部分切除ラットでも観察された。プロタミンの至的投与量1.6mg/kgは臨床投与量と同程度であった。プロタミン前投与により各種肝機能マーカーもHGF単独投与に比べて改善され、プロタミンとの併用によりHGFのもつ肝機能回復効果も増強されることが示された。 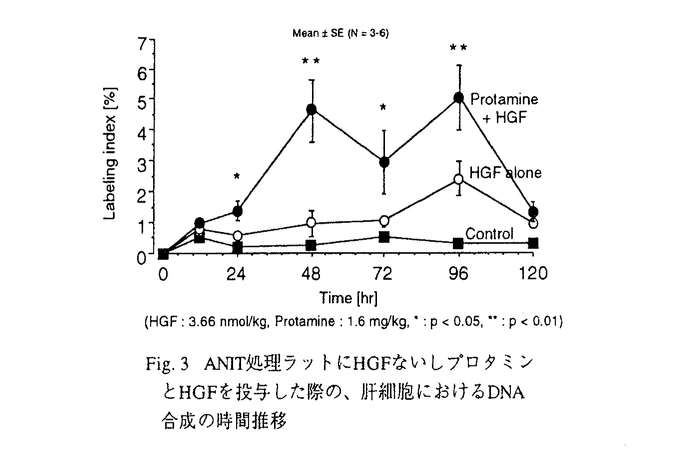 プロタミンの前投与によりHGFのCLplasmaは約40%にまで低下した。HGFを投与した後にプロタミンを投与すると血漿中HGF濃度の一過的な上昇が観察された。プロタミンはヘパリンaffinityカラムに結合したHGFを溶出させることから、ヘパリンに対してHGFと同一ないしはHGFとの結合を阻害しうる結合部位に結合することが示唆された。HGFのAUCとlabeling indexとの対応をとると、プロタミンによる増強効果はHGFの血中滞留性の上昇だけでは説明できないことが示唆された。実際、プロタミン(25 本研究ではラットにおけるHGFの非線形体内動態を解析し、投与量によらず肝臓が主要なクリアランス臓器であること、レセプター介在性エンドサイトーシスとそれ以外の消失機構の飽和によって体内動態に非線形性の生じることが示唆された。さらに、HGFの体内動態機構に基づきDDSの構築を試みたところ、in vivoでより有効にHGFを効かせるための方策として、ヘパリンよりもプロタミンを用いた方が有効であることが示された。これらの知見は、今後HGFを臨床応用していく上で有用なものであり、より低投与量で有効な治療効果を得るための方法論となる可能性を示すものである。 | |
| 審査要旨 | 肝細胞増殖因子(HGF)は、肝疾患治療薬としての開発が期待されているものの、in vivoで十分な治療効果を得るには極めて高投与量を必要とする。その原因の一つとして血中半減期が極めて短いことが挙げられる。これまで125I標識体を用いた解析から、tracer条件下でのHGFの主な消失臓器は肝臓であり、そのメカニズムは受容体介在性エンドサイトーシス(RME)と細胞表面のヘパラン硫酸プロテオグリカン(HSPG)を介する機構であることが考えられている。しかしこれら体内動態に関する報告はすべてtracer条件下に限られている。本研究においては、(i)薬理効果の得られる投与量も含めた種々の投与量におけるHGFの非線形体内動態ならびに消失機構を明らかにするとともに、(ii)HGFをin vivoでより有効に効かせるための方法論を構築することを目的として以下の検討を行った。 Tracer量の125I-HGFとヘパリンとをあらかじめ混合させた後にラットに静注したところ、血漿中濃度下面積(AUC)はヘパリンによって2-3倍に増加した。125I-HGFの臓器分布はいずれもヘパリンによりほぼ半分程度に低下した。分布をkg体重当たりに換算すると、主に肝臓への分布を低下させることによって血中滞留性の上昇したことが示唆された。 HGFによるラット初代培養肝細胞に対するDNA合成促進効果のEC50は、ヘパリン存在下で2-3倍程度上昇していた一方、最大効果にはほとんど影響がなかった。従って、ヘパリンはHGFのレセプターに対する見かけの親和性を低下させることが示唆された。 ラットにおいてHGFの全身クリアランス(CLplasma)は投与量の上昇とともに二相性の減少を示し、少なくとも2種類の非線形消失機構の存在が示唆された。また、種々の投与量のHGFの消失が肝結紮ラットにおいて大きく遅延していたことから、体内動態に非線形性の観察される投与量においても肝臓が主要な消失臓器であることが示された。以前の研究結果から、肝における消失機構のうちRMEの方がそれ以外の消失機構よりも高親和性であることが知られている。従って、肝臓におけるこれら2つの消失機構の飽和によってHGFの体内動態に非線形性の生じることが示唆された。 ヘパリンは投与量依存的に高投与量(1.46nmol/kg)HGFの消失を遅延させ、その効果はヘパリンの臨床投与量に近い0.4mg/kgで最大であった。この時の血漿中HGF濃度のAUCはコントロールに比べ20倍近くも上昇し、ヘパリンがHGFの血中滞留性を大きく上昇させることが明らかとなった。また、2種類の投与量のHGF消失に対する影響を考察することにより、ヘパリンが主にHGFのHSPGを介する消失を抑制する一方、レセプターによる消失も半分程度阻害することが示唆された。 35S-heparinとHGFとの結合親和性は解離定数0.3-0.5nMと高親和性である一方、ヘパリン一分子にHGF8-12分子が結合しうることが示唆された。これはHGF一分子と結合できる最小単位が5-6炭糖に相当することを意味する。 プロタミンを前投与することでHSPGへのHGFの結合をブロックし血中滞留性の上昇を期待するDDSを考案した。ANIT肝障害ラットではプロタミン前投与により肝細胞labeling indexはHGF単独投与の4-5倍に増加した。この作用はプロタミン投与量依存的であり、30%肝部分切除ラットでも観察された。プロタミンの至的投与量1.6mg/kgは臨床投与量と同程度であった。プロタミン前投与により各種肝機能マーカーもHGF単独投与に比べて改善され、プロタミンとの併用によりHGFのもつ肝機能回復効果も増強されることが示された。 プロタミンの前投与によりHGFのCLplasmaは約40%にまで低下した。HGFを投与した後にプロタミンを投与すると血漿中HGF濃度の一過的な上昇が観察された。プロタミンはヘパリンaffinityカラムに結合したHGFを溶出させることから、ヘパリンに対してHGFと同一ないしはHGFとの結合を阻害しうる結合部位に結合することが示唆された。HGFのAUCとlabeling indexとの対応をとると、プロタミンによる増強効果はHGFの血中滞留性の上昇だけでは説明できないことが示唆された。実際、プロタミン(25 以上より本研究ではラットにおけるHGFの非線形体内動態を解析し、投与量によらず肝臓が主要なクリアランス臓器であること、レセプター介在性エンドサイトーシスとそれ以外の消失機構の飽和によって体内動態に非線形性の生じることが示唆された。さらに、HGFの体内動態機構に基づきDDSの構築を試みたところ、in vivoでより有効にHGFを効かせるための方策として、ヘパリンよりもプロタミンを用いた方が有効であることが示された。これらの知見は、今後HGFを臨床応用していく上で有用なものであり、より低投与量で有効な治療効果を得るための方法論となる可能性を示すものであることから、博士(薬学)の学位を授与するのに値するものと認めた。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/50696 |
 g/ml)存在下でHGFによるラット初代培養肝細胞のDNA合成促進効果が増強されており、プロタミンによる直接的な促進効果が示唆された。
g/ml)存在下でHGFによるラット初代培養肝細胞のDNA合成促進効果が増強されており、プロタミンによる直接的な促進効果が示唆された。