|
|
|
|
|
| No | | 213702 |
| 著者(漢字) | | 小島,昭彦 |
| 著者(英字) | | |
| 著者(カナ) | | コジマ,アキヒコ |
| 標題(和) | | Pd触媒による多段階ワンポットプロセスを活用した生理活性天然物の全合成研究 |
| 標題(洋) | | |
| 報告番号 | | 213702 |
| 報告番号 | | 乙13702 |
| 学位授与日 | | 1998.02.12 |
| 学位種別 | | 論文博士 |
| 学位種類 | | 博士(薬学) |
| 学位記番号 | | 第13702号 |
| 研究科 | | |
| 専攻 | | |
| 論文審査委員 | | 主査: 東京大学 教授 柴崎,正勝
東京大学 教授 古賀,憲司
東京大学 教授 福山,透
東京大学 教授 長野,哲雄
東京大学 助教授 小田嶋,和徳
|
| 内容要旨 | | 【ハレナキノールの触媒的不斉合成】 ハレナキノン1およびハレナキノール2は、種々の熱帯産海綿からが単離された、ユニークな化学構造を有する天然物で(図1)、その生物活性は、抗菌、強心活性、並びに、特異的な逆転写酵素阻害活性や、チロシンキナーゼ阻害活性などが報告されている。1と2の全合成は、これまでに唯一、原田らにより達成されており、その合成ルートは、光学活性なWieland-Miescher ketoneを出発原料とするものである。 筆者の合成計画は、特徴的な縮合フラン環構造を、図1のように分子内にヨードエノールとアルキン部分を有する化合物14から、パラジウム触媒を用いてワンポット中で一挙に構築することとした。そして、14の有する不斉四級炭素は、柴崎研究室で開発された不斉ヘック反応によるベンジル位不斉四級炭素の構築法を発展させ、シンメトリーなジトリフレート8とボラン-オレフィン化合物10を用い、不斉リガンドを用いたパラジウム触媒存在下、スズキクロスカップリング反応とのワンポット反応により触媒的に構築することを計画した。 鍵中間体7の合成はすでに、柴崎研究室の竹元らにより式1のごとく行われている(3→4→5→6→7 8行程41%、87%ee、竹元利泰博士論文)。そこで、BINAPをリガンドとして、8と10とのワンポット反応を試みたところ、化学収率は20%ながら、85%eeという高い不斉収率で、7が得られることを見出した。この反応は、ヘック型反応の前の過程でクロスカップリング反応が進行している点で、従来のパラジウム触媒によるカスケード反応とは異なったタイプのワンポット反応であり、また新しい炭素骨格形成反応としても有用なものになりうると考えられ、さらなる検討を行った。その詳細は、後に記載する。  Scheme1Reaction conditions:(a)(1)TBDMSCL,Et3N,(2)Tf2O,Et3N(2 steps85%),(b)(1)CH2=CHCH2MgBr,cat.PdCl2(dppf)(quant),(2)9-BBN,(3)9,cat.PdCl2(dppf),K3PO4(90%),(c)(1)TBAF,(2)Tf2O,Et3N(2 steps 69%),(d)10mol % Pd(O)-(S)-BINAP,K2CO3(78%,87%ee),(e)Tf2O,pyridine(99%),(f)10,20mol%Pd(O)-(S)-BINAP,K2CO3(20%,85%ee). Scheme1Reaction conditions:(a)(1)TBDMSCL,Et3N,(2)Tf2O,Et3N(2 steps85%),(b)(1)CH2=CHCH2MgBr,cat.PdCl2(dppf)(quant),(2)9-BBN,(3)9,cat.PdCl2(dppf),K3PO4(90%),(c)(1)TBAF,(2)Tf2O,Et3N(2 steps 69%),(d)10mol % Pd(O)-(S)-BINAP,K2CO3(78%,87%ee),(e)Tf2O,pyridine(99%),(f)10,20mol%Pd(O)-(S)-BINAP,K2CO3(20%,85%ee). 7の天然物への誘導は式2のように行った。87%eeの7を用い、まず側鎖をアルコールとし、トリフレートとした後、アシルアニオン等価体17を作用させることにより、増炭反応を行ない、ケトンを再生して、3工程、82%で、ケトーアセチレン体12を得た。次にカルボニル基および末端アセチレン部を保護した13のベンジル位をDDQにより酸化後、そのカルボニル基の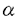 位を酸素酸化、さらにヨウ素を導入し、カルボニル基の保護を除去して、分子内閉環反応の基質14を効率よく合成することができた。 位を酸素酸化、さらにヨウ素を導入し、カルボニル基の保護を除去して、分子内閉環反応の基質14を効率よく合成することができた。 14に対し、DMF中、K2CO3存在下、Pd2(dba)3を作用させたところ、ワンステップで、ハレナキノールの母核を構築することに成功した。15のシリル基は、酢酸存在下、Bu4NFにより除去することで、16へ導くことができ、16の比旋光度の比較により、不斉四級炭素の絶対配置も正しいことが判明した。最終的に、原田らと同様な方法により、2および1へ導き、触媒的不斉全合成を達成した。 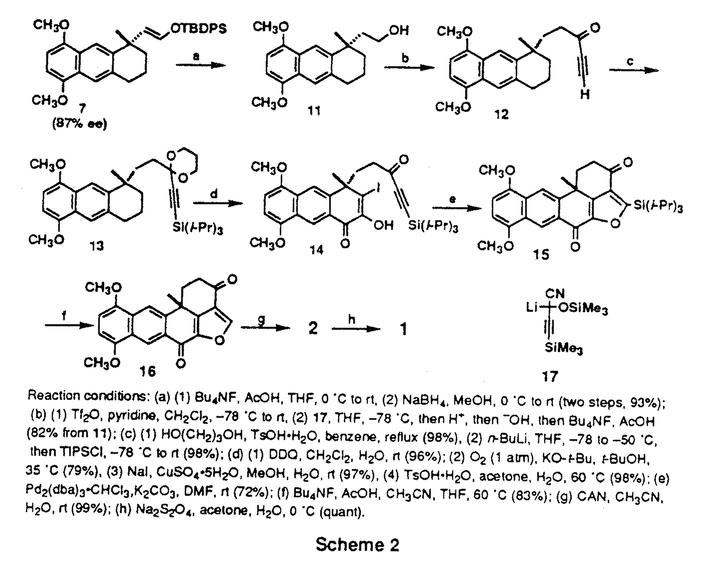 Scheme2Reaction conditions:(a)(1)Bu4NF,AcOH,THF,0℃ to rt,(2)NaBH4,MeOH,0℃ to rt(two steps,93%);(b)(1)Tf2O,pyridine,CH2Cl2,-78℃ to rt,(2)17,THF,-78℃,then H+,then -OH,then Bu4NF,AcOH(82% from 11);(c)(1)HO(CH2)3OH,TsOH・H2O,benzene,reflux(98%),(2)n-BuLi,THF,-78 to -50℃,then TIPSCL,-78℃ to rt(98%);(d)(1)DDQ,CH2Cl2,H2O,rt(96%);(2)O2(1atm),KO-t-Bu,t-BuOH,35℃(79%),(3)Nal,CuSO4・5H2O,MeOH,H2O,rt(97%),(4)TsOH・H2O,acetone,H2O,60℃(98%);(e)Pd2(dba)3・CHCl3,,K2CO3,DMF,rt(72%);(f)Bu4NF,AcOH,CH3CN,THF,60℃(83%);(g)CAN,CH3CN,H2O,rt(99%);(h)Na2S2O4,acetone,H2O,0℃(quant).【タンデムスズキクロスカップリング不斉ヘック反応の検討】 Scheme2Reaction conditions:(a)(1)Bu4NF,AcOH,THF,0℃ to rt,(2)NaBH4,MeOH,0℃ to rt(two steps,93%);(b)(1)Tf2O,pyridine,CH2Cl2,-78℃ to rt,(2)17,THF,-78℃,then H+,then -OH,then Bu4NF,AcOH(82% from 11);(c)(1)HO(CH2)3OH,TsOH・H2O,benzene,reflux(98%),(2)n-BuLi,THF,-78 to -50℃,then TIPSCL,-78℃ to rt(98%);(d)(1)DDQ,CH2Cl2,H2O,rt(96%);(2)O2(1atm),KO-t-Bu,t-BuOH,35℃(79%),(3)Nal,CuSO4・5H2O,MeOH,H2O,rt(97%),(4)TsOH・H2O,acetone,H2O,60℃(98%);(e)Pd2(dba)3・CHCl3,,K2CO3,DMF,rt(72%);(f)Bu4NF,AcOH,CH3CN,THF,60℃(83%);(g)CAN,CH3CN,H2O,rt(99%);(h)Na2S2O4,acetone,H2O,0℃(quant).【タンデムスズキクロスカップリング不斉ヘック反応の検討】 まず、BINAP以外の容易に入手できるいくつかの不斉リガンドを8→7の反応に適用したが、BINAPを凌駕する結果は得られなかった。そこで次に、容易に入手できる範囲で種々のアキラルなリガンドを本反応に試したところ、Ph3Asを用いたときに収率41%で7が得られ、パラジウム源、塩基等の最適化により、収率が、46%にまで向上することを見い出した。ラセミ体の合成ではあるが、この値はさきに示した8行程による全収率(41%)を越えるものである。この反応条件を用いると表1のように、本タンデム反応は種々の基質にも適用できることもわかり、新規骨格構築法として有用であると考えられる。  Table1【新規不斉リガンドBINAsの創製】 Table1【新規不斉リガンドBINAsの創製】 上記の知見から、本タンデム反応の不斉化には、BINAPのアルシンアナログであるBINAsが効果的と予想し、合成法を検討したところ、メルクのグループによって報告されたBINAPの合成法を若干改良することで、光学活性なBINAsを得ることに初めて成功した。 得られたBINAsを用いて、タンデム-スズキ-不斉ヘック反応(8→7)を行ったところ、収率13%、不斉収率40%で成績体が得られるにとどまった。しかし、表2に示したように、アルケニルヨーディド23を基質とした不斉ヘック反応の場合に、BINAsはBINAPに比ベて、明らかに反応を加速させており(entries1,2)、収率、不斉収率ともにBINAPよりも優れていることが判明した。この結果は、PdCl2(binap)を用いるこれまでの最適条件をも凌駕する結果である。一方、アルケニルトリフレート24を基質とした場合は、BINAPのほうがよい結果を与えていることを踏まえると、これらの知見は今後、BINAsとBINAPが相補的に活用される可能性を示唆するものと考えられる。  Table2 Table2 |
| 審査要旨 | | 【ハレナキノールの触媒的不斉合成】 ハレナキノン2およびハレナキノール1は、種々の熱帯産海綿から単離された、ユニークな化学構造を有する天然物で(図1)、その生物活性は、抗菌、強心活性、並びに、特異的な逆転写酵素阻害活性や、チロシンキナーゼ阻害活性などが報告されている。1と2の全合成は、これまでに唯一、原田らにより達成されており、その合成ルートは、光学活性なWieland-Miescher ketoneを出発原料とするものである。 小島昭彦の合成計画は、特徴的な縮合フラン環構造を、図1のように分子内にヨードエノールとアルキン部分を有する化合物14から、パラジウム触媒を用いてワンポット中で一挙に構築するものである。又、14の有する不斉四級炭素は、柴崎研究室で開発された不斉ヘック反応によるベンジル位不斉四級炭素の構築法を発展させ、シンメトリーなジトリフレート8とボラン-オレフィン化合物10を用い、不斉リガンドを用いたパラジウム触媒存在下、スズキクロスカップリング反応とのワンポット反応により触媒的に不斉構築するというものであった。 鍵中間体7の合成はすでに、柴崎研究室の竹元らにより式1のごとく行われている(3→4→5→6→7 8行程41%、87%ee、竹元利泰博士論文)。 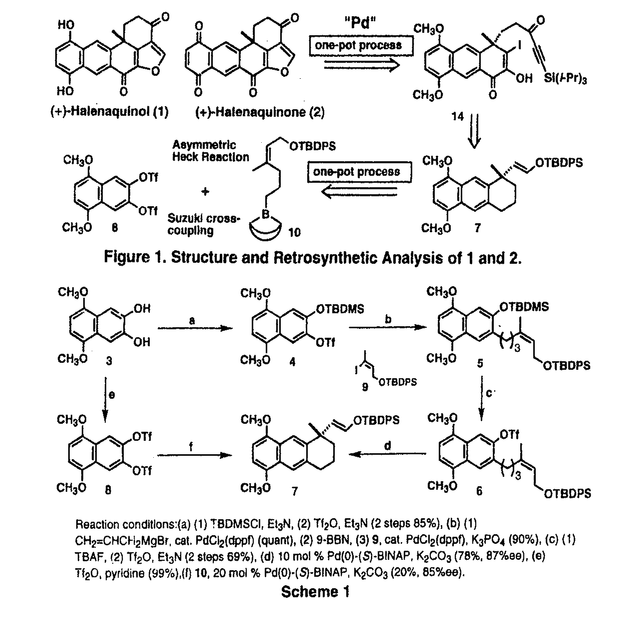 Scheme1Reaction conditions:(a)(1)TBDMSCl,Et3N,(2)Tf2O,Et3N(2 steps 85%),(b)(1)CH2=CHCH2MgBr,cat.PdCl2(dppf)(quant),(2)9-BBN,(3)9,cat.PdCl2(dppf),K3PO4(90%)、(C)(1)TBAF,(2)Tf2O,Et3N(2 steps 69%),(d)10mol % Pd(0)-(S)-BINAP,K2CO3(78%,87%ee),(e)Tf2O,pyridine(99%),(f)10,20 mol % Pd(0)-(S)-BINAP,K2CO3(20%,85%ee). Scheme1Reaction conditions:(a)(1)TBDMSCl,Et3N,(2)Tf2O,Et3N(2 steps 85%),(b)(1)CH2=CHCH2MgBr,cat.PdCl2(dppf)(quant),(2)9-BBN,(3)9,cat.PdCl2(dppf),K3PO4(90%)、(C)(1)TBAF,(2)Tf2O,Et3N(2 steps 69%),(d)10mol % Pd(0)-(S)-BINAP,K2CO3(78%,87%ee),(e)Tf2O,pyridine(99%),(f)10,20 mol % Pd(0)-(S)-BINAP,K2CO3(20%,85%ee). そこで、BINAPをリガンドとして、8と10とのワンポット反応を試みたところ、化学収率は20%ながら、85%eeという高い不斉収率で、7が得られることを見出した。この反応は、ヘック型反応の前の過程でクロスカップリング反応が進行している点で、従来のパラジウム触媒によるカスケード反応とは異なったタイプのワンポット反応であり、また新しい炭素骨格形成反応としても有用なものになりうると考えられ、後述のごとくさらなる検討が行なわれた。7から天然物への誘導は式2のように行ない触媒的不斉全合成を達成した。  Scheme2Reaction conditions:(a)(1)Bu4NF,AcOH,THF,℃ to rt,(2)NaBH4,MeOH,0℃ to rt(two steps,93%);(b)(1)Tf2O,pyridine,CH2Cl2,-78℃ to rt,(2)17,THF,-78℃,then H+,then -OH,then Bu4NF,AcOH(82% fom 11);(c)(1)HO(CH2)3OH,TsOH・H2O.benzene,reflux(98%),(2)n-BuLl,THF,-78 to -50℃,then TIPSCI,-78 ℃ to rt(98%);(d)(1)DDQ.CH2Cl2,H2O,rt(96%);(2)O2(1atm),KO-t-Bu,t-BuOH,35℃(79%),(3)Nal,CuSO4・5H2O,MeOH,H2O,rt(97%),(4)TsOH・H2O,acetone,H2O,60℃(98%);(e)Pd2(dba)3・CHCl3,K2CO3、DMF,rt(72%);(f)Bu4NF,AcOH,CH3CN,THF,60℃(83%);(g)CAN,CH3CN,H2O,rt(99%);(h)Na2S2O4,acetone,H2O,0℃(quant).【タンデムスズキクロスカップリング不斉ヘック反応の検討】 Scheme2Reaction conditions:(a)(1)Bu4NF,AcOH,THF,℃ to rt,(2)NaBH4,MeOH,0℃ to rt(two steps,93%);(b)(1)Tf2O,pyridine,CH2Cl2,-78℃ to rt,(2)17,THF,-78℃,then H+,then -OH,then Bu4NF,AcOH(82% fom 11);(c)(1)HO(CH2)3OH,TsOH・H2O.benzene,reflux(98%),(2)n-BuLl,THF,-78 to -50℃,then TIPSCI,-78 ℃ to rt(98%);(d)(1)DDQ.CH2Cl2,H2O,rt(96%);(2)O2(1atm),KO-t-Bu,t-BuOH,35℃(79%),(3)Nal,CuSO4・5H2O,MeOH,H2O,rt(97%),(4)TsOH・H2O,acetone,H2O,60℃(98%);(e)Pd2(dba)3・CHCl3,K2CO3、DMF,rt(72%);(f)Bu4NF,AcOH,CH3CN,THF,60℃(83%);(g)CAN,CH3CN,H2O,rt(99%);(h)Na2S2O4,acetone,H2O,0℃(quant).【タンデムスズキクロスカップリング不斉ヘック反応の検討】 まず、BINAP以外の容易に入手できるいくつかの不斉リガンドを8→7の反応に適用したが、BINAPを凌駕する結果は得られなかった。そこで次に、容易に入手できる範囲で種々のアキラルなリガンドを本反応に試したところ、Ph3Asを用いたときに収率41%で7が得られ、パラジウム源、塩基等の最適化により、収率が、46%にまで向上することを見い出した。ラセミ体の合成ではあるが、この値はさきに示した8行程による全収率(41%)を越えるものである。この反応条件を用いると表1のように、本タンデム反応は種々の基質にも適用できることもわかり、新規骨格構築法として有用であると考えられる。  Table1【新規不斉リガンドBINAsの創製】 Table1【新規不斉リガンドBINAsの創製】 上記の知見から、本タンデム反応の不斉化には、BINAPのアルシンアナログであるBINAsが効果的と予想し、合成した。得られたBINAsを用いて、タンデム-スズキ-不斉ヘック反応(8→7)を行ったところ、収率13%、不斉収率40%で成績体が得られるにとどまった。しかし、アルケニルヨーデイドを基質とした不斉ヘック反応の場合に、BINAsはBINAPに比べて、明らかに反応を加速させており、収率、不斉収率ともにBINAPよりも優れていることが判明した。この結果は、PdCl2(binap)を用いるこれまでの最適条件をも凌駕する結果である。一方、アルケニルトリフレートを基質とした場合は、BINAPのほうがよい結果を与えていることを踏まえると、これらの知見は今後、BINAsとBINAPが相補的に活用される可能性を示唆するものと考えられる。 以上の研究は、今後の医薬合成に多大な貢献をすることが期待され、博士(薬学)として十分な成果であると認めた。 |
| UTokyo Repositoryリンク | | |