未分化造血前駆細胞は芽球の形態を保ちながら増殖を続け、分化が誘導されると細胞分裂は止まり、成熟細胞へと形態学的な変化を受け、その後細胞死を迎える。この細胞死の実験室系モデルとして腫瘍壊死因子(TNF)-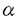 、並びに全トランス型レチノイン酸を用いた系が報告されている。特に後者においてヒト前骨髄球性白血病細胞株HL-60は形態的分化誘導を受け成熟好中性顆粒球になり、その後細胞死の誘導がもたらされることが確認されており、生理的な骨髄球系前駆細胞における細胞死の機構を解明する上で非常に有効なものと考えられている。本研究の目的は、この細胞死の過程を規定する本質的な分子を同定するために、発現クローニング法を用いてHL-60細胞を好中性顆粒球様形態に変化させ、その後細胞死を誘導させ得るcDNAクローンを選別、単離し、その機能を解析することにある。 、並びに全トランス型レチノイン酸を用いた系が報告されている。特に後者においてヒト前骨髄球性白血病細胞株HL-60は形態的分化誘導を受け成熟好中性顆粒球になり、その後細胞死の誘導がもたらされることが確認されており、生理的な骨髄球系前駆細胞における細胞死の機構を解明する上で非常に有効なものと考えられている。本研究の目的は、この細胞死の過程を規定する本質的な分子を同定するために、発現クローニング法を用いてHL-60細胞を好中性顆粒球様形態に変化させ、その後細胞死を誘導させ得るcDNAクローンを選別、単離し、その機能を解析することにある。 HL-60細胞を最終50nM全トランス型レチノイン酸添加後48時間培養しRNAを抽出、発現ライブラリーを作成した。サブプールに分けた後野性型HL-60細胞に電気穿孔法を用いて遺伝子導入を行ない、2日及び3日培養後顕微鏡下で形態変化を観察し、陽性クローンを選別した。選別の基準は、1)細胞が小さくなる、2)細胞質の好塩基性が低下する、3)核クロマチンが凝集し、多分葉化する、4)48時間後と比較して72時間後に死細胞数が増加する、の4点である。3個の陽性クローンを得、Hirt法を用いてプラスミドを回収しクローニングを進め、単一クローンを選別した。核酸塩基配列の結果から、単離したクローンはミトコンドリア由来アンチセンスチトクロームCオキシダーゼ/セリントランスファーRNA(MARCO)と判明した。 機能解析のためにIPTGによりMARCOの発現が誘導されるプラスミドをStratagene社のlac switch systemを用いて構築し、HL-60細胞に遺伝子導入して形質転換細胞を作成した。この系はlac operonを真核細胞へ応用したものであり、IPTG未添加では発現が抑制状態にあるcDNAがIPTG添加により高発現されることが確認されている。IPTG添加後36時間で高分子DNAの断片化を認め、48時間で成熟好中性顆粒球様の形態的変化が観察された。96時間後にはほとんどすべての細胞の細胞死が観察された。他の白血病細胞株としてヒト赤芽球系白血病細胞株K562及びヒト巨核芽球系白血病細胞株CMKを用いて、lac switch systemにより得た形質転換細胞に対して発現実験を行ったところ、同様の形態変化、高分子DNA断片化、及び細胞死が認められた。 Reverse transcriptase-polymerase chain reaction(RT-PCR)法によりMARCOの転写活性を観察すると、ヒト骨髄単核球及び血液単核球においては転写が認められなかったが、血液好中性顆粒球で転写が認められた。また全トランス型レチノイン酸添加後のHL-60細胞、及びTNF-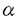 で刺激されたHL60細胞並びにU937細胞においてもPCR産物が確認された。 で刺激されたHL60細胞並びにU937細胞においてもPCR産物が確認された。 一方、チトクロームCオキシダーゼを構成的に高発現している形質転換細胞を作成し、TNF-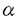 添加後の変化を観察すると、HL-60細胞に対する形態変化、U937細胞に対する細胞死の誘導並びに両細胞株に対する高分子DNA断片化が抑制された。 添加後の変化を観察すると、HL-60細胞に対する形態変化、U937細胞に対する細胞死の誘導並びに両細胞株に対する高分子DNA断片化が抑制された。 以上の研究結果から、 1)血球系の未分化前駆細胞の細胞死の誘導はミトコンドリア由来チトクロームCオキシダーゼの活性低下が関与している可能性がある。 2)好中性顆粒球において生理的に転写されているMARCOはその細胞死に関与している可能性がある。 3)TNF-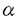 による細胞死の誘導にMARCO遺伝子が関与している可能性がある。 による細胞死の誘導にMARCO遺伝子が関与している可能性がある。 の3点が示唆された。 今後はMARCOの作用機序を解明していくと共に、白血病に対する遺伝子治療としてのMARCOの可能性を考え、その有用性及び安全性を動物実験を通じて評価していく方針である。 |