本研究は強力な抗腫瘍免疫を誘導し得る三種類の分子、GM-CSF,B7-1(CD80)またはIL-12の遺伝子を単独で、あるいは二種類同時にマウス肺癌細胞(Lewis lung carcinoma:LLC)に導入した株を樹立し、同系マウスモデルにおけるin vivoでの免疫応答様式の解析と効果の比較を行うことにより、ヒト肺癌に対する遺伝子治療に向けての基礎的解析を試みたものであり、下記の結果を得ている。 1.GM-CSF遺伝子導入LLCは、放射線処理後に腫瘍ワクチンとして同系マウスに接種した場合、親株に特異的かつ強力な抗腫瘍免疫を誘導した。しかし、放射線処理せずに接種した場合には親株と同様に腫瘍の形成を生じ、有効な免疫応答は誘導されなかった。 2.B7-1遺伝子導入LLCを同系マウスに接種した場合、造腫瘍性が著明に抑制された。この抑制は、宿主のCD8+T細胞に依存した。しかし、GM-CSFの場合とは異なり、LLC/B7を拒絶したマウスでは親株に対する抗腫瘍免疫は殆ど誘導されなかった。LLC/B7のMH Cclass I(H-2Kb)の発現をin vitroで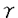 -interferon処理で誘導した場合にも抗腫瘍免疫の増強は起こらなかった。 -interferon処理で誘導した場合にも抗腫瘍免疫の増強は起こらなかった。 3.GM-CSFとB7-1遺伝子の両者を同時に導入・発現させたLLCでは、LLC/B7と同程度にin vivoの造腫瘍性が抑制され、かつLLC/GM+B7を拒絶したマウスでは、LLC/B7よりも抗腫瘍免疫が有意に強力に誘導された。In vitro CTL assayでもLLC/GM+B7で免疫したマウスにおいてLLC/B7よりも約3倍強力なキラー活性が誘導されていた。 4.IL-12遺伝子導入LLCでは、in vivoの造腫瘍性が強力に抑制される一方で親株に対する抗腫瘍免疫も強く誘導された。すなわち、IL-12は一分子でGM-CSFとB7-1の両分子が誘導する作用を合わせ持つような様式の腫瘍免疫を誘導し得た。この免疫はCD4+T,CD8+TさらにNK細胞に依存して見られ、特にCD4+TとCD8+Tの両者の関与が大きかった。また、in vitroのCTL assayおよびcold target inhibition testより、IL-12は親株に特異的なキラー活性と非特異的なキラー活性の両者を同時に誘導した。 5.LLC/IL12は、治療用ワクチンとして用いた場合にも有意な治療効果を認めた。一方、LLC/B7やLLC/GMでは治療効果は全く認めなかった。また、IL-12+B7-1の同時発現LLCやIL-12+GM-CSFの同時発現LLCでもIL-12単独に比べ効果の増強は無く、この腫瘍モデルにおいては、IL-12が誘導する抗腫瘍免疫が最も強力な活性をもたらすと考えられた。 以上、本論文は強力な抗腫瘍免疫誘導能を有する三種類の分子が、in vivoにおいてそれぞれ異なる様式で免疫を誘導する事、またそれらの特性を生かした組合せを用いれば更に有効な免疫が誘導されうることを示している。また、これら三分子の効果比較を十分に行った報告はこれまでになく、ヒト肺癌に対する免疫遺伝子治療の臨床応用を目指した基礎的研究モデルとして重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 |