HIV-1感染症の流行において、母児感染の急激な増加が問題となっている。感染の大半が産道感染であるため、出産前にAZTの投与を行い母親側の血中ウイルス量を減らすことにより感染の予防が行われている。感染予防法の一つとして中和抗体のpassive transferについても検討されている。したがって母児感染におけるシークエンスの多様性について解析することは、病期の進行に関与していることともあわせ、ワクチンおよび中和抗体のpassive transferの有用性を検討する上で重要である。 まず第一章では、HIV-1の水平・垂直同時期感染例由来株について、V3ループのシークエンス解析を行いそれぞれ比較した。父親由来ウイルス株のV3ループは多クローン性を示し、主要中和領域(principal neutralizing domain;PND)のコア領域においても変異が認められ、抗PND中和抗体の結合活性は多様性を示していた。これに対し、母親由来の水平感染株のV3コア領域のシークエンスは収束しており、中和抗体の結合活性および中和活性が認められた。新生児由来の垂直感染株においてもV3コアシークエンスは収束していたが、母親由来株のコアシークエンスとは既に一致していなかった。また、新生児の主要なクローンはスロットブロット解析で中和抗体と結合することができたが、変異したマイナークローンは結合活性を失っていた。系統樹解析により母親から胎児へは中和抗体と結合できる主要なクローンが感染していたことが示唆された。これらの知見から、垂直感染および水平感染には、ウイルスクローンの選択性が認められ、また、垂直感染したウイルスは水平感染したウイルスよりもV3領域において急速に変異することが示唆された。この結果は、一症例についての所見ではあるが、母児感染における新生児への治療法を確立する上で有用な情報になると思われた。 このような複雑なHIV-1感染の機序を解明し、また予防治療法を開発するため、これまで、HIV-1の感染モデルとしてチンパンジー、ヒヒやプタオサルが報告されており、また最近ではSIVとHIVのキメラウイルスを用いた赤毛サルの感染系も報告されている。しかし、人、設備、時間、経済的理由で、マウス等の小動物を用いたAIDSの動物モデルの開発が望まれており、重症免疫不全マウス(Severe Convined Immunodeficiency mouse;SCID)やトランスジェニックマウスを用いた研究が行われてきた。そこで第二章において、SCIDマウス(C.B-17scid/scid)にヒト免疫系を導入したSCID-huマウスを作成し、抗HIV候補物質のin vivoスクリーニング系としてさらにHIV感染の病態生理を研究するモデルとして検討した。 SCIDマウスは、リンパ球系細胞において免疫グロブリンおよびT細胞レセプター遺伝子の再構成ができないため分化が停止し、T細胞、B細胞が正常に機能できない変異マウスで、重症複合型免疫不全症のモデル動物として報告された。同種のみならず異種間においても対宿主移植片反応が認められないため臓器移植が可能で、ヒト末梢血単核球(PBMC)、または胎児の胸腺および肝臓の同時移植を行うことによりヒトリンパ球が長期にわたり維持されることが報告されている。 そこでSCIDマウスにヒト胎児胸腺および肝臓を同時に移植したSCID-huマウスを作製し、HIV-1の自然感染に近い経路であると考えられる静脈内接種によりHIVBRUを接種し、感染の成立を検討した。その結果、HIV接種マウスでは、PCRにより移植胸腺においてウイルスゲノムが検出され、組織染色によりウイルス非接種の対照マウスに比較して明らかな移植胸腺髄質の狭窄が認められた。また、免疫組織染色により、移植胸腺髄質のハッサル小体周辺の胸腺上皮細胞にウイルス抗原が検出された。このように、SCID-huマウスにおいて経静脈接種によるHIV-1感染の成立が認められたことから、自然感染の経路に近い感染モデルとして、抗HIV候補薬のスクリーニング系などへの応用が期待された。 次に第三章では、SCID-huマウスおよびヒト正常末梢血リンパ球を移入したhu-PBL-SCIDマウスを作製し、抗HIV候補物質として作製したヒト型化抗HIVモノクローナル抗体R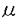 5.5について実際にin vivoにおける評価を行った。R 5.5について実際にin vivoにおける評価を行った。R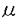 5.5は抗原認識部位以外をヒト遺伝子でreshapeしたHIVMN株のV3PND領域のIHIGPGRAFYTを認識する抗体で、in vitroにおけるPHA刺激ヒトPBMCを標的細胞として用いた感染阻止実験においてHIVMN株および初代臨床分離株の一部をほぼ完全に中和することができた。そこで、この抗体のMN株および臨床分離株のin vivoでの感染阻止効果を検討するためにSCID-huおよびhu-PBL-SCIDマウスを用いて実験を行った。PCRおよびサザンハイプリダイゼーションにより解析したところ、SCID-huおよびhu-PBL-SCIDマウスにおいて抗体投与群は非投与群に比較して明らかに感染を阻止していることが確認された。また、移植組織、脾臓、腹腔滲出細胞等より感染性ウイルスの分離を行いその効果の判定を行ったところ抗体投与群では、非投与群に比較して分離は抑制されており、感染の阻止効果が認められた。さらに、組織学的解析によりコントロール抗体投与群では第二章で認められたように移植胸腺髄質の狭窄が認められたのに対し、R 5.5は抗原認識部位以外をヒト遺伝子でreshapeしたHIVMN株のV3PND領域のIHIGPGRAFYTを認識する抗体で、in vitroにおけるPHA刺激ヒトPBMCを標的細胞として用いた感染阻止実験においてHIVMN株および初代臨床分離株の一部をほぼ完全に中和することができた。そこで、この抗体のMN株および臨床分離株のin vivoでの感染阻止効果を検討するためにSCID-huおよびhu-PBL-SCIDマウスを用いて実験を行った。PCRおよびサザンハイプリダイゼーションにより解析したところ、SCID-huおよびhu-PBL-SCIDマウスにおいて抗体投与群は非投与群に比較して明らかに感染を阻止していることが確認された。また、移植組織、脾臓、腹腔滲出細胞等より感染性ウイルスの分離を行いその効果の判定を行ったところ抗体投与群では、非投与群に比較して分離は抑制されており、感染の阻止効果が認められた。さらに、組織学的解析によりコントロール抗体投与群では第二章で認められたように移植胸腺髄質の狭窄が認められたのに対し、R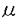 5.5投与群では無処置の胸腺組織と同様の構造を呈しており、HIV感染を阻止していることが示唆された。 5.5投与群では無処置の胸腺組織と同様の構造を呈しており、HIV感染を阻止していることが示唆された。 現在、ワクチン開発や抗HIV候補物質の開発にあたり初代臨床分離株を中和できるかどうかという点は極めて重要な検討事項になっている。しかしながら、in vitroでの中和試験は、実験系の条件により左右され、再現性のある結果が得られないという問題点が議論されている。そこで、これらのマウスを用いたin vivoの系を取り入れることにより、より自然状態に近いデータが得られるものと思われる。ところで、臨床分離株を用いることが可能な感染系としてはチンパンジーが挙げられるが、感染させるウイルス量や、動物管理の面で問題がある。この点において、SCID-huおよびhu-PBL-SCIDマウスはチンパンジーの一部を代用でき、これを検討できる動物モデルとなる可能性がある。したがって、SCIDマウスへのヒト細胞の定着性、SCID-huマウスにおける抗原に対する一次免疫応答の誘導、ウイルス感染に対してのより完成された免疫反応を目指し改良することが望まれる。 そこで第四章では、免疫不全マウスの一つでT細胞依存性の糖尿病発症マウスNOD/LtマウスにSCIDマウス(C.B-17scid/scid)を交配させて作成されたNOD/LtSz-scid/scid(NOD-scid)マウスを用いて検討を行った。このマウスは、SCIDマウス同様T細胞、B細胞が正常に機能できないだけでなくNOD/Ltマウスの特徴としてNK活性の欠損、血中の補体(C5)の欠如、抗原提示細胞の分化・機能の低下を示す。このNOD-scidマウスにヒトPBMCを腹腔内に移入したhu-PBL-NOD-scidマウスを作製し、各臓器におけるヒトおよびマウスCD45陽性細胞をFACSにて解析したところ、これまでSCIDマウスでは認められなかったような全身の臓器への高率なヒトリンパ球の移入が認められた。さらに組織の免疫染色の結果、脳においてもヒトCD45陽性細胞が移入していることが明らかになった。そこで次に、hu-PBL-NOD-scidマウスに対するHIVMN株の感染性について検討した。感染2週間後、各組織より感染性ウイルスの分離を行ったところ、末梢血をはじめ脾臓、肝臓、腹腔滲出細胞、リンパ節、胸腺、さらに脳からも高濃度のウイルスが分離された。この系を用いてプロテアーゼ阻害薬のHIV-1感染抑制効果について検討したところ、脾臓、肝臓、腹腔滲出細胞、リンパ節、末梢血において感染の阻止効果が認められ、抗HIV-1薬の評価系としての有用性が示唆された。さらに注目すべき点は、ヒトPBMC投与5日目には、各臓器にヒト細胞が移行しており、特にリンパ節において顕著に認められた。さらに、ヒトCD14陽性細胞、CD19陽性細胞も認められ、T細胞の多くはCD45RA陽性のnaive T細胞であった。各免疫担当細胞が、このように投与一週間目までの初期においてリンパ系臓器に認められるという結果より、移植初期に抗原を投与することによりヒトのprimaryな免疫応答が誘導できる可能性が示唆された。これらの結果よりNOD-scidは今後より有用なモデル動物として利用できることが示唆される。 本研究から、免疫不全マウスにヒト組織を移植したSCID-huマウスおよびhu-PBL-NOD-scidマウスは今後抗HIV候補物質のスクリーニングに有用な感染モデルになると考えられ、さらにHIV感染の発症機構や病態の解明に寄与することも期待される。 |