グリコーゲンシンターゼ(UDPglucose-glycogen 4-glucosyltransferase,EC2.4.1.11)はグリコーゲンにUDPグルコースを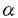 -1.4結合で付加する酵素である。 -1.4結合で付加する酵素である。  この酵素はグリコーゲン合成における律速酵素で、細胞にブドウ糖を取り込む糖輸送担体、ブドウ糖をリン酸化するヘキソキナーゼ、とならんで筋肉における糖の利用促進に重要な働きをする。 グリコーゲンシンターゼはインスリンにより活性化される。インスリンによるグリコーゲンシンターゼの活性化機構に関しては以前から1)グリコーゲンシンターゼはインスリン刺激により脱リン酸化されると活性化し、逆にリン酸化されると不活性化される。2)グリコーゲンシンターゼを脱リン酸化するのはグリコーゲンシンターゼホスファターゼであり、これはインスリン刺激により活性化する。3)グリコーゲンシンターゼをリン酸化するグリコーゲンシンターゼキナーゼも存在し、これはインスリン刺激により不活性化する。ということが知られていたが、インスリン刺激よりグリコーゲンシンターゼの活性化にいたる細胞内情報伝達経路については長い間不明のままであった。 近年の研究の進歩により、インスリン作用にかかわる細胞内情報伝達経路として、p21Ras(Ras)の活性化よりmitogen-activated protein kinase(MAPキナーゼ)を経てp90 S6キナーゼに至る経路やホスファチジルイノシトール3-キナーゼ(PI3-キナーゼ)の関与する経路、p70 S6キナーゼの関与する経路など多数の情報伝達分子を経由するシグナルが複雑に分岐していることが知られるようになってきた。グリコーゲンシンターゼの活性化機構に関しても、p90 S6キナーゼおよびp70 S6キナーゼの関与する可能性が提示された。そこで本研究ではインスリンおよびインスリン様成長因子I(IGF-1)によるグリコーゲンシンターゼの活性化に関与している細胞内情報伝達経路についての検討をおこなった。 以下の実験にはPC12細胞を用いた。まずRasよりMAPキナーゼ(ERK1,ERK2)を経てp90 S6キナーゼに至る経路の関与を検討するために、Rasの活性化を阻害するRasの優性抑制性変異体Ras Asn-17(Ras17N)の発現がデキサメサゾン処理により誘導される細胞(PC12Ras17N細胞)の解析を行った。Ras17Nの発現を誘導するとインスリンおよびIGF-1によるMAPキナーゼおよびp90 S6キナーゼの活性化が抑制されるのが観察されたがインスリンおよびIGF-1刺激によるグリコーゲンシンターゼの活性化は抑制されなかった。したがってインスリンおよびIGF-1によるグリコーゲンシンターゼの活性化にはRas→MAPキナーゼ→p90 S6キナーゼという経路は必要でないものと考えられた。 次にPI3-キナーゼ活性の阻害薬として知られているワートマニン(wortmannin)および2-(4-morpholinyl)-8-phenyl-4H-1-benzopyran-4-one(LY294002)の効果を検討した。これらの薬剤がインスリンおよびIGF-1によるグリコーゲンシンターゼの活性化を阻害することが観察された。このことよりインスリンおよびIGF-1によるグリコーゲンシンターゼの活性化にPI3-キナーゼが関与する可能性が提示された。 さらに生細胞においてPI3-キナーゼの下流に位置する分子であると考えられているp70 S6キナーゼがグリコーゲンシンターゼの活性化に関与するか否かを検討するためp70 S6キナーゼの阻害剤であるラパマイシン(rapamycin)のグリコーゲンシンターゼ活性化に対する効果について検討をおこなった。インスリンおよびIGF-Iによるグリコーゲンシンターゼの活性化はラパマイシンによっては阻害されなかった。したがってPC12細胞ではインスリンおよびIGF-1によるグリコーゲンシンターゼの活性化にはp70 S6キナーゼは必要ではないものと考えられた。 以上の成績はp90 S6キナーゼおよびp70 S6キナーゼがインスリンによるグリコーゲンシンターゼ活性化をになうという仮説が誤りであることを指摘し、ワートマニンおよびLY294002感受性の経路がインスリンおよびIGF-1によるグリコーゲンシンターゼの活性化に重要であることを明らかにした。 |