ヒアルロン酸は細胞外マトリックスとして広く生体内に存在し、コンドロイチン硫酸プロテオグリカンや他のマトリックス構成物質との相互作用によりヒアルロン酸を芯とした巨大な会合体を形成し、細胞外マトリックスに安定性と可塑性をもたらす。生体内においてヒアルロン酸は直接的ないし間接的に多くの細胞活動に関与している。 ヒアルロン酸の生理活性として、先に、我々は角膜内皮に対して、in vitroウシ角膜内皮創傷治癒モデルを用いて、ヒアルロン酸に角膜内皮創傷治癒促進作用があることを示した。ヒアルロン酸は創傷初期に治癒を促進するが、後期には促進せず、また5-Bromo-2’deoxyuridineを用いた取り込み実験において取り込みの増加が見られないことから、ヒアルロン酸は創傷治癒の早期にウシ角膜内皮細胞の伸展促進などにより治癒を促進するが、細胞分裂は促進しないと考えられた。更にフィブロネクチンとの間に創傷治癒促進の相乗作用がみられることから、ヒアルロン酸の創傷治癒メカニズムは独立のものであると考えられた。 ヒアルロン酸はin vitroで多くの細胞を取り巻き、細胞コートを形成している。中皮腫細胞の由来細胞である正常ヒト中皮(NHM)細胞が大量のヒアルロン酸を産生するのに対して、その変異細胞である中皮腫細胞はヒアルロン酸を産生せず、代わりに線維芽細胞やNHMのヒアルロン酸合成刺激能をもつ因子を産生する。NHM細胞は細胞周囲コートによって囲まれているが、中皮腫細胞は囲まれていない。この違いを利用して、先に、我々は細胞周囲コートの性状について研究した。 NHM細胞を3H-グルコサミン存在下で培養し、培養液、細胞周囲及び細胞内の各分画に関して選択的な酵素消化に基いてヒアルロン酸及びコンドロイチン硫酸の回収線量を同定した。対照として中皮腫細胞Mero-14を同様に分析した。NHM細胞の培養液及び細胞周囲分画中の標識された多糖鎖のおよそ80から90%がヒアルロン酸でありコンドロイチン硫酸は3-5%のみであった。反対にMero-14ではヒアルロン酸は極めて少量であり、培養の全グリコサミノグリカンの61%がコンドロイチン硫酸であった。その結果からコート形成にはヒアルロン酸合成が必要条件であると考えられた。また細胞周囲層の透過性を赤血球(直径7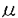 m)と同様にポリスチレン微小球及び細菌(直径0.1-3.0 m)と同様にポリスチレン微小球及び細菌(直径0.1-3.0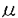 m)を用いての検討では、赤血球はコートから排除されたが、より小さな粒子はコートに侵入した。0.5mg/mlのコンドロイチン硫酸プロテオグリカン(CS-PG)を培養液に加えることではコートの大きさは変わらなかったが、CS-PG含有コートはCS-PGのないコートよりも効果的に粒子及び細菌を排除した。外部由来のプロテオグリカンは細胞周囲層の構造を強化しうる。また中皮腫細胞の培養上清は血小板由来増殖因子(PDGF)や上皮増殖因子類似の活性を持ち、NHM細胞においてヒアルロン酸合成を刺激し、更にコートの形成も刺激することを示した。これらの観察からin vivoの近傍細胞はヒアルロン酸と相互作用するマトリックス成分や細胞のヒアルロン酸合成を刺激する因子の放出によって細胞周囲コートの密度及び大きさの双方に影響を与えうると考えられた。 m)を用いての検討では、赤血球はコートから排除されたが、より小さな粒子はコートに侵入した。0.5mg/mlのコンドロイチン硫酸プロテオグリカン(CS-PG)を培養液に加えることではコートの大きさは変わらなかったが、CS-PG含有コートはCS-PGのないコートよりも効果的に粒子及び細菌を排除した。外部由来のプロテオグリカンは細胞周囲層の構造を強化しうる。また中皮腫細胞の培養上清は血小板由来増殖因子(PDGF)や上皮増殖因子類似の活性を持ち、NHM細胞においてヒアルロン酸合成を刺激し、更にコートの形成も刺激することを示した。これらの観察からin vivoの近傍細胞はヒアルロン酸と相互作用するマトリックス成分や細胞のヒアルロン酸合成を刺激する因子の放出によって細胞周囲コートの密度及び大きさの双方に影響を与えうると考えられた。 このように中皮腫細胞の培養上清が主にヒアルロン酸からなるNHM細胞の細胞コート形成を刺激し、またヒアルロン酸の合成も刺激することから、本論文では、ヒアルロン酸の生合成の制御機構としてヒアルロン酸の生合成おけるシグナル伝達及び合成酵素遺伝子発現に関し研究した。 シグナル伝達の研究には、眼球由来の適当な細胞株がないため、市販されていて入手の容易な包皮線繊芽細胞を用いた。角膜内皮細胞は時に線維芽細胞様に形態変化することがあるが、この形態変化時に通常の内皮細胞で産生されているIV型コラーゲン産生が低下し、代わってI,III,V型原線維コラーゲン産生の増加がみられ、単なる形態変化に留まらず線維芽細胞様の機能的変化もきたしている。 本研究ではPDGF-BB及びトランスフォーミング増殖因子(TGF)-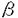 1がタンパク合成に一部依存する、即ちヒアルロン酸合成酵素発現誘導を含むメカニズムによってヒアルロン酸合成を促進することを示した。特異的抑制因子を用いた実験結果に基づきシグナル伝達系はプロテインキナーゼ(PK)Cの活性化を含むことが分かった。更にPKCの直接の活性化は、タンパク合成に依存しないヒアルロン酸産生の増加を刺激する。このことからPKCは直接ヒアルロン酸合成酵素をリン酸化し活性化するか、酵素を活性化させる構造体をリン酸化することが可能となる。 1がタンパク合成に一部依存する、即ちヒアルロン酸合成酵素発現誘導を含むメカニズムによってヒアルロン酸合成を促進することを示した。特異的抑制因子を用いた実験結果に基づきシグナル伝達系はプロテインキナーゼ(PK)Cの活性化を含むことが分かった。更にPKCの直接の活性化は、タンパク合成に依存しないヒアルロン酸産生の増加を刺激する。このことからPKCは直接ヒアルロン酸合成酵素をリン酸化し活性化するか、酵素を活性化させる構造体をリン酸化することが可能となる。 PDGF-BBはヒト線維芽細胞の増殖を刺激する一方、TGF-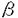 1は条件により細胞の増殖を抑制または促進する。しかし今回の研究から両因子ともヒアルロン酸産生を促進することが示された。PKCは両因子のシグナル伝達系において主要な役割を担っているとみられる。即ち、PDGF-BBないしTGF- 1は条件により細胞の増殖を抑制または促進する。しかし今回の研究から両因子ともヒアルロン酸産生を促進することが示された。PKCは両因子のシグナル伝達系において主要な役割を担っているとみられる。即ち、PDGF-BBないしTGF-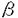 1により誘導されたヒアルロン酸産生刺激の大半はPKC抑制因子であるcalphostin Cによって抑制された。PDGF刺激後のPKC活性化をおこす機構としてはphospholipase C(PLC)- 1により誘導されたヒアルロン酸産生刺激の大半はPKC抑制因子であるcalphostin Cによって抑制された。PDGF刺激後のPKC活性化をおこす機構としてはphospholipase C(PLC)-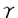 を含むシグナル伝達経路がある。しかし、PLC- を含むシグナル伝達経路がある。しかし、PLC-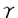 の活性化を阻害するPDGFレセプターの特殊な変異細胞においてもPDGF刺激によるヒアルロン酸産生がおきるという今回のデータからすると、PDGFによるヒアルロン酸合成においてPLC- の活性化を阻害するPDGFレセプターの特殊な変異細胞においてもPDGF刺激によるヒアルロン酸産生がおきるという今回のデータからすると、PDGFによるヒアルロン酸合成においてPLC-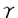 を含まない経路も考えられる。即ちPKCがPDGF刺激の後、他のフォスフォリパーゼなどの別の系を通じて活性化された可能性がある。シグナル伝達分子であるphosphatidylinositol 3’-kinase(Pl-3’K)はPDGFで活性化され、ケモタクシスやアクチンの再構成といったPDGFの多くの効果を媒介する点で重要であることが示されており、また細胞分裂促進性については、その特異的阻害因子であるwortmanninによる阻害がみられないことからヒアルロン酸合成刺激においては重要ではない。for skolinはヒアルロン酸合成をわずかに刺激するという事実から、PKAがヒアルロン酸合成酵素をリン酸化し活性化するか、酵素を直接活性化する可能性がある。for skolinがPDGF-BBに誘導されたヒアルロン酸合成を阻害するという結果から、PKAはPDGFのシグナル伝達系、例えば分裂誘発因子活性化タンパク(MAP)キナーゼカスケードの活性化に負の制御をしていると考えられる。こうしてヒアルロン酸合成酵素のmRNAおよびタンパクのPDGF刺激による誘導を阻害することが可能となる。Pl-3’K抑制因子のwortmanninないしPLC抑制因子のU-73122によってTGF- を含まない経路も考えられる。即ちPKCがPDGF刺激の後、他のフォスフォリパーゼなどの別の系を通じて活性化された可能性がある。シグナル伝達分子であるphosphatidylinositol 3’-kinase(Pl-3’K)はPDGFで活性化され、ケモタクシスやアクチンの再構成といったPDGFの多くの効果を媒介する点で重要であることが示されており、また細胞分裂促進性については、その特異的阻害因子であるwortmanninによる阻害がみられないことからヒアルロン酸合成刺激においては重要ではない。for skolinはヒアルロン酸合成をわずかに刺激するという事実から、PKAがヒアルロン酸合成酵素をリン酸化し活性化するか、酵素を直接活性化する可能性がある。for skolinがPDGF-BBに誘導されたヒアルロン酸合成を阻害するという結果から、PKAはPDGFのシグナル伝達系、例えば分裂誘発因子活性化タンパク(MAP)キナーゼカスケードの活性化に負の制御をしていると考えられる。こうしてヒアルロン酸合成酵素のmRNAおよびタンパクのPDGF刺激による誘導を阻害することが可能となる。Pl-3’K抑制因子のwortmanninないしPLC抑制因子のU-73122によってTGF-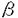 1のヒアルロン酸合成刺激効果が阻害されず、PKC抑制因子のcalphostin Cで阻害されることから、PKCないしこれに関係ある酵素が重要な役割をなし、Pl-3’KないしPLC- 1のヒアルロン酸合成刺激効果が阻害されず、PKC抑制因子のcalphostin Cで阻害されることから、PKCないしこれに関係ある酵素が重要な役割をなし、Pl-3’KないしPLC-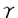 は重要でないと考えられる。また今回検討したヒトの線維芽細胞においてはPDGF中和抗体がTGF- は重要でないと考えられる。また今回検討したヒトの線維芽細胞においてはPDGF中和抗体がTGF-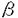 1によるヒアルロン酸合成促進の抑制効果を示さなかったことから、TGF- 1によるヒアルロン酸合成促進の抑制効果を示さなかったことから、TGF-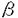 1のヒアルロン酸合成刺激効果にはPDGFの誘導は関与していないことが示された。 1のヒアルロン酸合成刺激効果にはPDGFの誘導は関与していないことが示された。 近年ヒアルロン酸合成酵素遺伝子がStreptococcus pyogenesのhas A領域においてクローニングされた。更に最近になって哺乳類におけるヒアルロン酸合成酵素がクローニングされマウス及びヒトにおける構造が明らかになった。Northernブロッティングにて2.4kbの遺伝子が、ヒトの卵巣組織で強く発現し、脾臓、胸腺、前立腺、精巣及び大腸において発現がみられる。 今回の研究ではNHM細胞、Mero-14各々からpoly(A)+RNAを精製し、各々5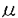 gを電気泳動後ナイロンメンブレンに転移し、ヒトヒアルロン酸合成酵素遺伝子をSacllで切断しプローブとしたNorthernブロティングをおこなった。ヒアルロン酸細胞周囲コートをもちヒアルロン酸を多量に産生するNHM細胞においてヒアルロン酸合成酵素遺伝子の発現が確かめられ、またヒアルロン酸をほとんど産生せずコートをもたない中皮腫細胞,Mero-14においては遺伝子の発現がみられなかった。このNHM細胞Mero-14のモデルにおいて、ヒアルロン酸合成酵素遺伝子の発現とヒアルロン酸産生能とが平行していることが確かめられた。 gを電気泳動後ナイロンメンブレンに転移し、ヒトヒアルロン酸合成酵素遺伝子をSacllで切断しプローブとしたNorthernブロティングをおこなった。ヒアルロン酸細胞周囲コートをもちヒアルロン酸を多量に産生するNHM細胞においてヒアルロン酸合成酵素遺伝子の発現が確かめられ、またヒアルロン酸をほとんど産生せずコートをもたない中皮腫細胞,Mero-14においては遺伝子の発現がみられなかった。このNHM細胞Mero-14のモデルにおいて、ヒアルロン酸合成酵素遺伝子の発現とヒアルロン酸産生能とが平行していることが確かめられた。 今回の研究においてヒアルロン酸の生合成が増殖因子によって制御されており、主にPKCの系に依っていることを示した。創傷治癒促進効果や細胞コートなどの生理作用をもつヒアルロン酸の合成が生体内においてダイナミックに制御されている可能性が示唆された。また最近クローニングがなされたヒアルロン酸合成酵素遺伝子の発現をヒアルロン酸産生細胞で確認した。今後、ヒアルロン酸合成刺激に対するシグナル伝達系の遺伝子レベルでの更なる解明が期待される。遺伝子組み換えヒアルロン酸合成酵素ができれば、異なったキナーゼによるリン酸化の酵素活性を直接的に研究することも可能となる。これらの研究によって、より効果的、選択的な治療が可能になることが期待される。 |